首页 > 医疗资讯/ 正文
治疗相关神经毒性
化疗和免疫疗法用于治疗恶性血液肿瘤常会引起神经损伤,不良事件介于轻微的认知障碍和头痛到癫痫、中风和脑炎等严重事件。为了优化患者管理,临床医生需要了解神经损伤的机制、临床表现以及器官损伤的管理策略。《Blood Reviews》近日发表综述,阐述了化疗和免疫疗法(不含放疗)治疗血液肿瘤时引起神经毒性的类型、机制、诊断、管理和预防。

发病率
神经毒性的发病率差异较大。神经毒性症状可能在癌症治疗早期出现,也可能延迟发作,在治疗结束后数月至数年才出现。这些延迟的神经毒性作用可引起相当大的发病率,特别是在长期癌症幸存者中,包括已成功治疗全身性癌症和儿童时期接受恶性肿瘤治疗的患者。下图为大概的神经毒性发病率,下文每个部分也会详细分析特定类别的化疗和免疫治疗药物的神经毒性综合征的发病率。
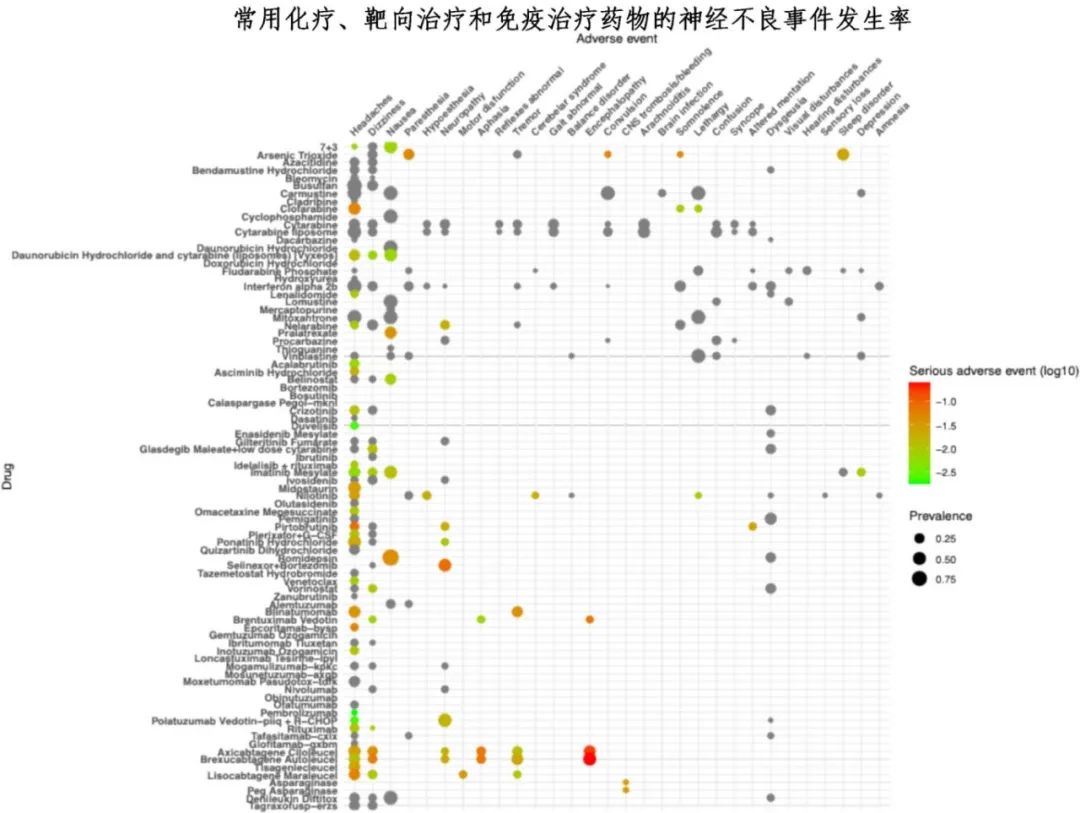
化疗相关神经毒性的诊断、预防和管理
化疗诱导的周围神经病变
化疗引起的周围神经病变(PN)是包括长春生物碱类(长春新碱、长春花碱、长春瑞滨和长春地辛)、铂类化合物(顺铂、卡铂、奥沙利铂)、nelarabine、紫杉烷类(紫杉醇、多西他赛、卡巴他赛)、静脉注射蛋白酶体抑制剂(硼替佐米、卡非佐米)和沙利度胺在内的多种化疗和靶向治疗药物中最常见的神经毒性之一。该毒性作用多表现为长度依赖性感觉轴突多发性神经病变,表现为手脚麻木、感觉异常和神经性疼痛。随着累积剂量的增加,症状往往会恶化,导致手部和脚部麻木,以及轻触、振动和针刺感知的受损和本体感觉的降低。常与长春新碱和硼替佐米相关的自主症状包括腹痛、便秘、体位性低血压、膀胱功能障碍、胃排空延迟和心率变异性降低。受严重影响的患者由于本体感觉丧失和感觉性共济失调而有跌倒的风险。每种药物类别都呈现出不同的临床模式。
长春花碱类药物提取自长春花植物,用于霍奇金和非霍奇金淋巴瘤以及 T 细胞白血病的化疗。长春新碱具有高度的神经毒性,导致 18% - 70%的成年人以及高达 78%的儿童出现PN,症状包括肌肉无力、痉挛、自主神经病变等。长春花碱引发PN的风险低于长春新碱,影响 12%-56%的患者,多达 12%的患者出现重度周围神经病变,不过一些研究报告称没有严重病例。长春瑞滨很少引发PN,但可能会加剧接受硼替佐米治疗的患者原有的神经病变。长春花碱类药物引发的周围神经病变是一种重要的治疗毒性,然而对其了解不足;这在儿童肿瘤治疗中尤为重要,因为长期周围神经病变会在数十年内影响生活质量。
蛋白酶体抑制剂用于多发性骨髓瘤的治疗。PN是硼替佐米常见的副作用,往往需要减少、延迟或停止治疗剂量。硼替佐米诱发PN的发病率取决于治疗相关的因素,如给药周期、累积剂量和给药途径。报告的周围神经病变发病率在8%至80%之间,严重神经病变为1-33%。与每周一次剂量相比,高剂量强度和每周两次与周围神经病变发生率的增加相关;硼替佐米通过皮下给药比通过静脉给药发生PN的风险更低。硼替佐米诱发PN的症状主要为感觉性,包括四肢(尤其是下肢)麻木和刺痛;小神经纤维受累表现为脚趾和鞋底的锐痛和灼痛;自主神经功能障碍症状包括心率变异性降低、体位性低血压、胃排空延迟,以及胃肠道症状、尿或性功能障碍。硼替佐米治疗可能罕见的导致一种伴有自主症状的脱髓鞘感觉运动神经病变,可能免疫介导,因为对免疫治疗有阳性反应。与硼替佐米相比,卡非佐米导致总体神经病变减少(6% vs 32%),并且与来那度胺和地塞米松联合使用时不会增加神经病变的风险。伊沙佐米是第一种口服蛋白酶体抑制剂,与来那度胺和地塞米松联合使用时神经病变的发生率也没有增加(任何级别神经病变 27%)。硼替佐米和依沙米基于硼酸骨架,而卡非佐米基于环氧酮结构;结构差异可能会影响神经毒性,但机制尚未完全明了。神经毒性可能与蛋白酶体抑制的疗效以及泛素化蛋白聚集体的形成或脱靶效应相关。硼替佐米还可以通过非蛋白酶体依赖的机制导致神经毒性,包括靶向丝氨酸水解酶,而卡非佐米等环氧化酮类药物不会影响丝氨酸蛋白酶或抑制神经突的生长。
免疫调节剂常用于治疗多发性骨髓瘤。沙利度胺引起的PN表现为感觉和感觉运动神经病变,表现为手指和脚趾麻木或疼痛性感觉异常;运动功能受累较少见,且通常发生在严重的症状中。多达 75%的患者发生PN,且剂量高于 200mg/天和治疗持续时间较长的患者发病率更高。沙利度胺还会引起自主症状,如体位性低血压、头晕和心动过缓。沙利度胺与硼替佐米联合使用会增加神经病变的风险。来那度胺神经毒性较低(≥2级为2.8%)。在诱导(总体 18% vs 49%,严重 1% vs 7%)和维持(总体 19% vs 57%,严重 2% vs 18%)治疗期间,其神经毒性均显著低于沙利度胺。来那度胺联合硼替佐米的PN发生率低于沙利度胺联合硼替佐米,长期随访显示 50%的患者出现感觉轴神经病变。泊马度胺PN 发生率与单独使用地塞米松相似(总体分别为 15%和 11%,≥3级均为 1%)。然而一项 II 期研究报告称,40%的患者出现 PN,中位至发病时间为 1.7 个月,但严重毒性率低(1.6%)。免疫调节剂对于血液恶性肿瘤至关重要,但 PN 限制了其长期使用。在多发性骨髓瘤中,长期的维持治疗加剧了 PN 的影响。尽管新型药物的神经毒性有所降低,但了解和减轻 PN 仍存在挑战。需要改进治疗和预防策略,以提高耐受性和改善预后。
铂类化合物(如顺铂和奥沙利铂)与PN相关。在血液系统恶性肿瘤中,关于铂类药物引起的周围神经病变的具体数据有限。血液系统恶性肿瘤的治疗方案通常使用较低累积剂量的顺铂,因此多发性骨髓瘤(所有级别5%-10%,≥3级0%-3%)和非霍奇金淋巴瘤和霍奇金淋巴瘤的周围神经病变报告较少。铂类化合物常用于重度经治患者的挽救治疗,因此准确评估PN较为复杂,但铂类药物引起的PN仍是重大问题,尤其是在与其他神经毒性药物联合治疗时。铂类药物会诱导DNA加合物导致神经病变,尤其是听力损失,而核苷酸切除修复(NER)途径在通过核糖体RNA转录修复加合物方面效率低下。鉴于背根神经节神经元的代谢活动较高,核糖体RNA合成中断对这些细胞有害。铂类化合物与线粒体DNA(mtDNA)结合,由于缺乏DNA修复机制,会导致活性氧物质(ROS)的积累和氧化应激。来自体外和体外研究的数据报告,铂暴露会导致线粒体的组织学和功能损伤,mtDNA复制受损,ATP产生受损。
Nelarabine用于治疗 T 细胞急性淋巴细胞白血病和 T 细胞淋巴瘤,是脱氧鸟嘌呤类似物 9-β-D-阿拉伯呋喃糖基鸟嘌呤(Ara-G)的前体药物。在临床试验中,≥3 级神经毒性发生率在 7%至 28%之间,其中约 80%为可逆的感觉或运动神经病变。Nelarabine后第二常见的神经系统表现为癫痫发作,其原因是 Ara-G 的代谢产物 Ara-GTP 在脑脊液和神经元中积聚,并被纳入 DNA 中,导致神经元损伤和细胞凋亡。另一种机制是在神经元细胞核内形成 DNA 加合物。
对于化疗引起的PN,检测、监测和分级的最佳方法尚无共识。在过去二十年中,国际研究小组投入了大量精力,旨在解决这一临床和科学上的差距。此外医生和患者对其及其对生活质量(QoL)的影响也有着不同看法。FACT/GOG-NTX 评分和 EORTC CIPN20 评分是广泛使用的患者报告结果,而总神经病变评分(TNS)是可靠的临床报告结果。有人担心 NCI-CTCAE 量表在评估化疗引起的周围神经病变(CIPN)方面的适用性。最近的研究验证了 FACT/GOG-NTX 和 TNSc 的响应性和最小临床重要差异,当正式的神经学检查有困难时,TNS 护士版本(TNSn)视为可靠替代方案。其他工具(如神经传导检查)对于测试周围神经系统的远端分支很有价值,但只能检测到大、有髓纤维的损伤,而不能检测到小纤维的损伤。新兴的神经影像学技术(如超声和磁共振神经图谱)很有前景,但需要更多的数据。血清生物标志物正在研究中,尤其是神经丝轻链(NfL),动物模型和小型临床研究的初步数据很有希望。尽管有这些进展,目前尚无有效的预防或治疗CIPN的方法。ASCO最近的一项荟萃分析适度推荐度洛西汀用于症状治疗,但尚无神经保护药物证明有效。减轻症状的手段也可能包括调整治疗方案,用神经毒性较小的药物(如免疫调节剂[来那度胺和泊马度胺])替代药物,或选择不同的给药形式,如用皮下蛋白酶体抑制剂抑制剂替代静脉制剂。
急性脑病
急性脑病是一种在化疗后数小时至数天内迅速发作的脑功能障碍,特征为定向障碍、意识模糊、躁动,并有可能进展为昏迷。急性脑病通常与亚急性脑病(具有可逆性弥散加权成像模式的急性-亚急性白质脑病)一起考虑。其他特征包括肌阵挛、癫痫发作和幻觉。急性脑病必须与其他病症区分开来,如非惊厥性癫痫状态或代谢紊乱。
化疗引起的急性脑病的最常见诱因之一是甲氨蝶呤,它能抑制二氢叶酸还原酶,减少四氢叶酸的形成,改变髓鞘合成,并因髓鞘周转受损导致脑病。二氢叶酸还原酶的抑制会导致叶酸和钴胺素的耗竭,以及大脑循环中同型半胱氨酸浓度的增加,从而造成内皮损伤,最终可能导致癫痫发作和血管疾病。二氢叶酸还原酶的抑制会导致 S-腺苷甲硫氨酸(SAM)浓度降低,SAM 是维持髓鞘完整性的关键成分,鞘内注射甲氨蝶呤后可能导致脱髓鞘。
甲氨蝶呤还抑制 5 -氨基咪唑- 4-羧酰胺核糖核苷酸甲酰基转移酶(ATIC),该酶会刺激腺苷的释放,腺苷与腺苷受体结合,改变中枢神经系统的神经反应。腺苷、其受体(ADORA1 和 ADORA2A)与各种中枢神经系统疾病之间存在关联。腺苷对 ADORA2A 的作用(后者具有与神经毒性相关的不同多态性[rs2298383 和 rs5760410])可通过增强兴奋性神经递质损害神经元和白质。某些基因型,如 SLC19A1(c.80G > A),与出现严重神经毒性的风险增加有关,并且可以通过二代测序(NGS)等分子技术进行检测。
阿糖胞苷和部分烷化剂(如静脉注射异环磷酰胺)也常与急性脑病有关,这些药物对中枢神经系统的祖细胞和少突胶质细胞有毒性,会损害体外细胞分裂。阿糖胞苷也可能损害非分裂的少突胶质细胞,还会导致细胞死亡,并抑制体内细胞分裂,对中枢神经系统的细胞结构和再生过程产生不利影响。阿糖胞苷的神经毒性与剂量有关;大剂量与神经毒性风险增加有关。在某些情况下,大剂量皮质类固醇治疗可能会观察到反应率和可逆性,表明存在炎症机制。大剂量阿糖胞苷(HDAC)治疗患者中,肾功能不全与神经毒性密切相关。在肾衰竭患者中,阿糖胞苷代谢产物阿拉伯糖苷酸(AraU)在中枢神经系统的积累与直接神经元损伤有关。在儿童中,有若干急性神经毒性病例,为中度至重度甚至致命。
天冬酰胺酶有 3 种制剂:天然大肠杆菌门冬酰胺酶 L-门冬酰胺酶、聚乙二醇化大肠杆菌天冬酰胺酶(培门冬酶和 calaspargase pegol-mknl)及欧文氏门冬酰胺酶,它们在药代动力学和耐受性方面存在差异。L-门冬酰胺酶引起的中枢神经系统神经毒性可能导致缺血性中风(其发病率随年龄增长而增加,儿科患者为 5%,30 岁成年人约为 40%)或出血(2%)以及高氨血症(约 10%)。L-门冬酰胺酶会产生三种神经毒性物质:氨、L-门冬氨酸和谷氨酸,它们会刺激 NMDA(N-甲基-D-天冬氨酸)受体,可能导致代谢性脑病,表现为个性和记忆障碍,严重情况下会发展为昏迷和脑死亡。与门冬酰胺酶相关的急性代谢性脑病可以通过低蛋白摄入和乳果糖以减少肠道氨的形成、静脉注射苯甲酸钠以及口服苯丁酸钠来治疗。然而研究表明,新型制剂,如培门冬酶和calaspargase可显著降低神经毒性,3 期研究显示中枢神经系统血栓形成、出血或脑病的罕见病例(<1%)极少见。
在成人和儿童 T 细胞急性淋巴细胞白血病患者中,使用nelarabine治疗后也报告了急性脑病的病例。
急性脑病的典型MRI特征包括弥漫性或局灶性白质改变、脱髓鞘区域以及皮质和皮质下异常(T2/FLAIR、DWI 高信号)。可能是部分或完全恢复,但也可能发生不可逆的损伤和死亡。儿童长期幸存者中报道了工作记忆等长期认知能力受损的情况。预防措施包括仔细监测,以及可能的中断治疗。中枢神经系统毒性的风险取决于药物、剂量、途径、治疗持续时间和其他风险因素。通过叶酸衍生物和给予 NMDA 拮抗剂右美沙芬(机制未知)使 SAM水平正常化是潜在的有益干预措施。
急性小脑综合征
大剂量阿糖胞苷治疗后可出现急性小脑综合征,最早于 80 年代报道。在新型药物(如蛋白酶体抑制剂(硼替佐米)和单克隆抗体(如利妥昔单抗)的使用中也有相关报道,其特征为头晕、共济失衡,构音障碍、眩晕、恶心、呕吐以及眼球运动障碍。MRI可能正常,也可能显示幕上和幕下区域的可逆性白质 T2/FLAIR 高信号,提示急性中毒性脑病。除了停用假定的致病药物外,尚无预防或治愈的干预措施。恢复尚不确定,范围介于缓解至坐位和行走时的持续性致残性共济失调。
急性脊髓病
急性脊髓病可导致下肢瘫痪或四肢瘫痪,是甲氨蝶呤和/或阿糖胞苷鞘内治疗的罕见并发症;可在一次注射后发展,潜在地影响脑干,导致类似于闭锁综合征或致命的“脑脊髓炎”的特征。风险因素包括广泛的脑膜瘤、中枢神经系统辐射以及极端的年龄。这是一种坏死性脊髓病,目前尚无有效治疗。有病例报告称,通过叶酸、维生素 B12 和蛋氨酸使血清叶酸(SAM)水平正常化后部分好转;也有完全脑脊液交换治疗的报告,但尚未得到证实。
急性脑血管综合征
由于肿瘤本身具有潜在的血液凝固倾向以及患者所接受的治疗,肿瘤患者更有可能患上中风和其他形式的脑血管疾病。甲氨蝶呤、环孢素、阿霉素和铂类方案等化疗药物会增加中风的风险。与动脉粥样硬化性中风不同的是,这些患者通常会出现可逆性中风症状,而且大多数化疗相关的中风患者在治疗后没有功能障碍。L-门冬酰胺酶与静脉窦血栓形成和出血性中风有关。
颅神经病变
几乎所有的化疗药物都可能导致嗅觉丧失、视力丧失和眼部并发症、听力损失、前庭综合征、面部无力、吞咽困难等神经毒性。不做详细讨论。
亚急性脑病
亚急性脑病较为罕见,通常在接受甲氨蝶呤或铂类化合物治疗数日至数周后发病,其表现为意识模糊、癫痫发作以及偏瘫和失语等症状。亚急性脑病主要影响儿童,但成人也可能发病。其发病机制尚不明确。MRI扫描显示弥散加权成像中对称性高信号以及表观扩散系数降低,提示为白质细胞毒性水肿。症状可能会完全缓解,但也有致命病例。对于甲氨蝶呤诱导的脑病患儿,建议使用右美沙芬(NMDA非竞争性拮抗剂)或氨茶碱(腺苷诱导的血管扩张拮抗剂),但尚未得到证实。
慢性脑病
慢性脑病可能在数月至数年内发展,有时呈进行性,且往往不可逆。慢性脑病最常与静脉注射甲氨蝶呤有关,较少与用于治疗非霍奇金淋巴瘤的方案(如 CHOP 方案)有关。同时进行全脑放疗是甲氨蝶呤相关慢性脑病的主要危险因素。其症状从细微的记忆障碍和定向障碍到痴呆不等。目前没有有效治疗。脑部影像学通常显示白质脑病和进行性深部脑萎缩。应注意的是,广泛的甲氨蝶呤相关白质脑病可能无症状。
化疗相关慢性认知障碍(CRCI,化疗性脑损伤)
化疗相关认知障碍通常称为化疗性脑损伤(chemobrain),是指在患有非中枢神经系统肿瘤的患者中,与几乎所有化疗相关的肿瘤治疗相关的认知功能下降,其特征为轻度至中度认知障碍,在治疗后试图恢复正常活动时变得明显。受影响最大的认知领域包括记忆、执行功能和处理速度。症状包括难以集中注意力、多任务处理和学习新技能,以及语言和视觉记忆问题、注意力持续时间延长和词语提取困难。患者常报告感觉精神模糊、混乱无章,并抱怨完成日常任务的时间变长。神经心理学效应因肿瘤类型和治疗而异,其时间进程也各不相同,通常在化疗结束时出现,但也可能更早出现。认知下降通常在治疗后的前三年内有所改善。化疗性脑损伤可能与情感障碍有关,如焦虑和抑郁,导致误诊。症状和进展的可变性凸显了个性化管理方法的必要性。
目前没有经证实有效的干预措施,也没有标准化的诊断标准或检测,导致不同肿瘤类型和研究中报告的患病率各不相同。评估主观认知功能障碍的手段包括癌症治疗认知功能功能评估(FACT-Cog),它与生活质量恶化相关。客观评估需要进行神经心理学测试,国际认知与癌症工作组推荐的核心测试包括修订版霍普金斯言语学习测试、控制性口头词语联想测试和连线测试。还建议进行其他测试,如工作记忆、执行功能和复杂注意力测试,如听觉辅音三联音和有节奏的听觉连续加法测试。认知评估应纵向进行,理想情况下在治疗前开始并持续进行。这些测试可能无法检测到肿瘤幸存者中细微的认知变化,导致患者抱怨与正常分数不匹配。功能性MRI表明,尽管神经心理学测试结果正常,但存在代偿性大脑激活,可能是认知抱怨的原因。目前缺乏针对化学性脑病的准确成像、分子和生物标志物,也没有经过验证有效的干预措施,建议采取多方面的方法,包括安抚、治疗共病、身体活动、行为干预和认知训练。身体活动和认知训练似乎有用,但方案和评估结果不一致。预防和症状管理的药物策略包括中枢神经系统刺激剂如莫达非尼和抗痴呆药物如多奈哌齐、银杏叶。这些药物尚未在随机对照试验中证明有效,其使用也有限。解决该问题还需要进一步的研究和支持性策略来改善结局。
进行性多灶性白质脑病(PML)
进行性多灶性白质脑病(PML)是一种罕见但严重的中枢神经系统脱髓鞘疾病,主要发生在免疫功能低下的人群中,尤其是 CD4 或 CD8 T 细胞抑制的人群。症状包括记忆力减退、失语、动作不协调、四肢进行性无力、面部下垂、步态异常、偏盲或皮质失明。诊断基于高危人群的亚急性神经症状、典型的MRI表现以及脑脊液中John Cunningham病毒(JCV)DNA 的检测。维布妥昔单抗是一种双特异性抗体,通过杀伤活化的 B 细胞和 T 细胞导致轴突运输中断以及周围神经病变或免疫抑制,也可能促进潜伏的 JC 病毒感染的重新激活并引发PML。目前尚无有效的预防或治疗。
Guillain-Barr´e综合征
Guillain-Barr´e综合征是一种急性神经肌肉麻痹的形式,表现为急性、快速进展的弛缓性麻痹,影响四肢,伴有深腱反射减少或消失。感觉障碍可能存在也可能不存在。Guillain-Barr´e综合征可能是恶性肿瘤本身的表现,也可能是治疗的后果,并且与蛋白酶体抑制剂和检查点抑制剂(等)有关。长春地辛(用于成人 T 细胞白血病和淋巴瘤)与其他长春生物碱类相比较少发生PN;极少数病例会类似Guillain-Barr´e综合征。Guillain-Barr´e综合征的治疗应包括静脉注射免疫球蛋白(IVIg)和泼尼松龙。鉴于这种疾病可能致命,还建议停止抗癌治疗。
免疫治疗相关神经毒性的诊断与管理
该部分分析与免疫疗法相关的神经毒性,包括单克隆抗体、双特异性抗体、抗体药物偶联物、免疫检查点抑制剂和过继性细胞疗法。由于相关数据较少而不探讨抗癌疫苗。
免疫检查点抑制剂介导的神经毒性
免疫检查点抑制剂(ICI)通过阻断细胞毒性抑制信号(如PD1、PD-L1或CTLA-4)触发抗肿瘤免疫应答,引起的神经毒性综合征较为罕见,据报道,≥3 级事件的发生率低于 1%。一项涵盖 59 项临床研究的荟萃分析显示,接受抗 CTLA-4 抑制剂的患者中有 3.8%,接受抗 PD-1 抑制剂的患者中有 6.1%,同时接受两者联合治疗的患者中有 12.0%出现神经毒性。这些毒性分为七种免疫检查点抑制剂介导的神经毒性核心综合征:脑膜炎、脑炎、脱髓鞘疾病、血管炎、神经病变、神经肌肉接头紊乱和肌病。据推测,毒性是由 T 细胞激活以及 PD-1/PD-L1 和 CTLA-4 通路的抑制增强免疫反应并诱发自身免疫引起的。据报道,纳武利尤单抗治疗后淋巴瘤患者可出现脑炎。ICI 治疗后报告了血管炎,但区分 ICI 介导的和副肿瘤性不良事件具有挑战性。症状通常为非特异性,可能在治疗数周后出现。ICI 介导的神经毒性通常是排除性诊断。ICI和皮质类固醇停药是主要的干预措施,很少使用血浆置换和/或静脉注射免疫球蛋白(IGIV)、环孢素、环磷酰胺或利妥昔单抗。约有半数患者可康复。
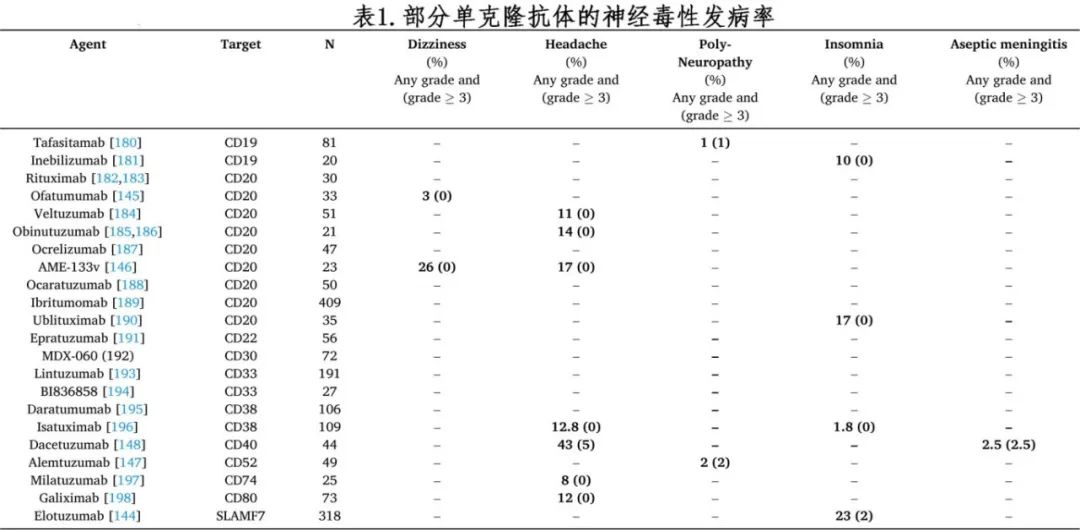
单克隆抗体
本文分析了 24 种用于治疗血液肿瘤的单克隆抗体。最常见的神经系统不良事件见表 1,≥3 级毒性发生率在 0 至 5%之间。轻度头痛通常用对乙酰氨基酚治疗。使用elotuzumab后有严重失眠的报告。使用ofatumumab和 AME-133v(人源化 IgG1 单链抗 CD20 抗原的单克隆抗体,可作用于健康和恶性的 B 淋巴细胞)后有“头晕”的报告。使用alemtuzumab治疗 6 个月后报告有治疗后 6 个月出现的外周多神经病变。使用dacetuzumab治疗后报告有无菌性脑膜炎。使用ofatumumab治疗后报告了伴有神经后遗症的严重颈动脉狭窄。
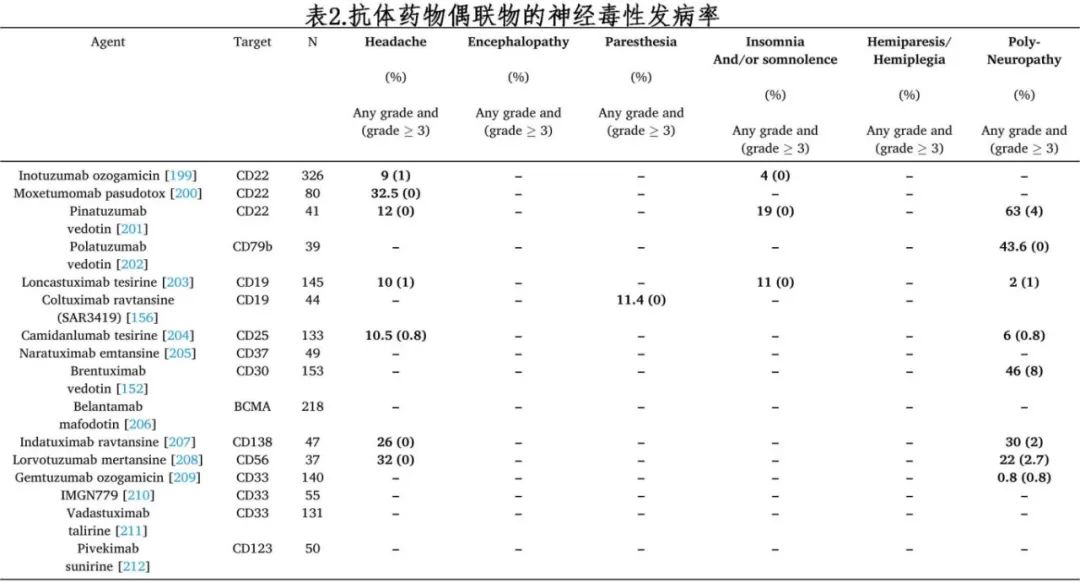
抗体药物偶联物
作者分析了 16 种用于血液肿瘤的抗体药物偶联物(ADC),最常见的神经系统不良事件见表 2,≥3 级毒性发生率在 0 至 8%之间。由于维布妥昔单抗、维泊妥珠单抗和pinatuzumab vedotin等 ADC 无法有效地穿过血脑屏障,神经毒性通常表现为运动或感觉性周围神经病变。与神经毒性最常相关的是monomethyl auristatin E(MMAE),它是一种微管抑制剂;神经元不是分裂细胞,但它们需要完整的微管来进行轴突运输,基于 MMAE 的 ADC 被神经细胞非特异性摄取,从而改变其功能。周围神经病变表现为感觉症状,包括感觉异常、麻木、四肢疼痛,较少见的是运动症状,如无力或麻痹。接受 MMAE 偶联的 ADC 的患者发生周围神经病变的风险较高。轻度感觉或运动异常感觉除了停用 ADC 外,不需要任何干预。更严重情况的干预措施包括三环类抗抑郁药、5-羟色胺和去甲肾上腺素再摄取抑制剂(SSRIs 和 SNRIs),如度洛西汀、加巴喷丁类药物以及物理治疗。与 ADC相关的其他神经系统症状为非特异性事件,如头痛和头晕。coltuximab ravtansine治疗后报告了 1 例罕见的进行性多灶性白质脑病的病例。
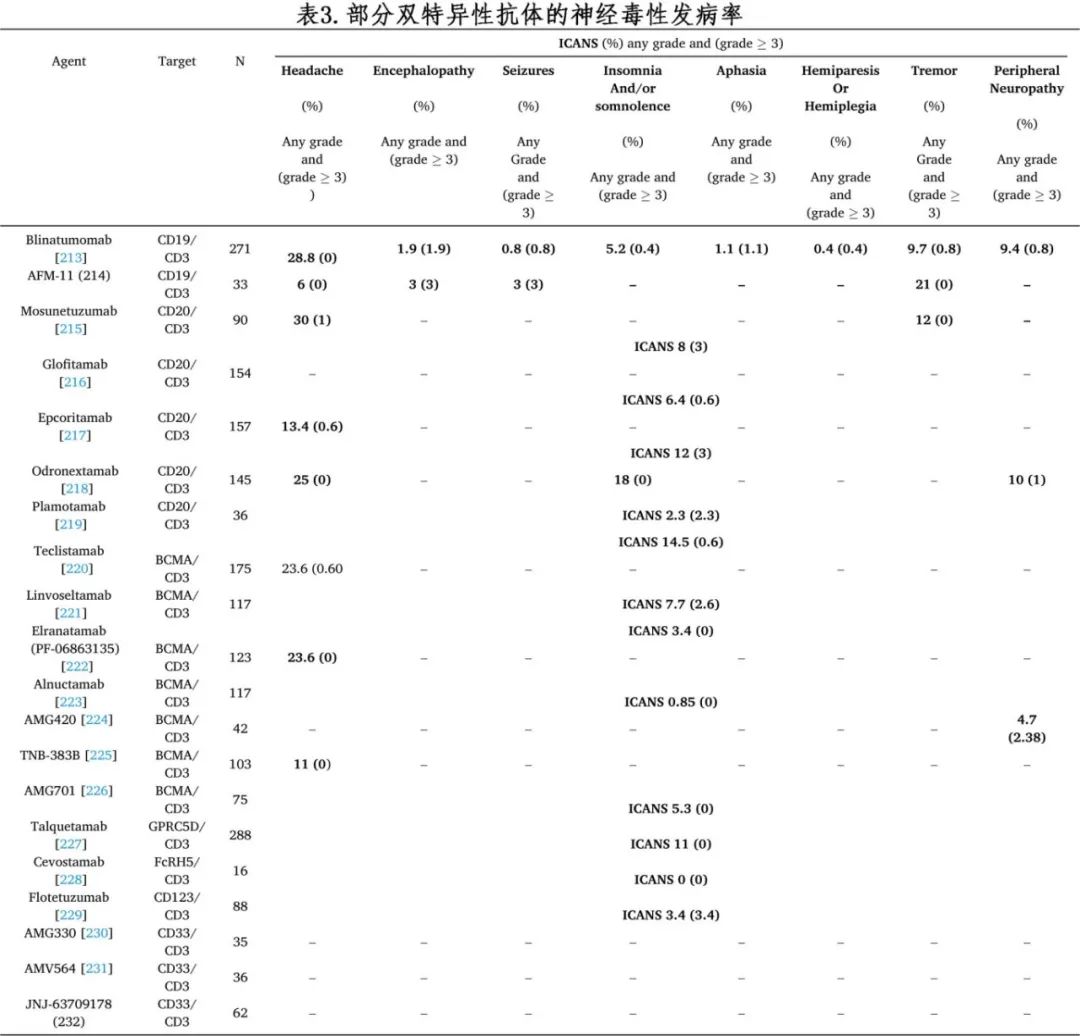
免疫效应细胞介导的神经毒性(ICANS)
ICANS以前称为细胞因子释放性脑病综合征(CRES),双特异性 T 细胞结合(BiTE)抗体的发生率高于单抗但低于 CAR-T(表 1、3 和 4)。
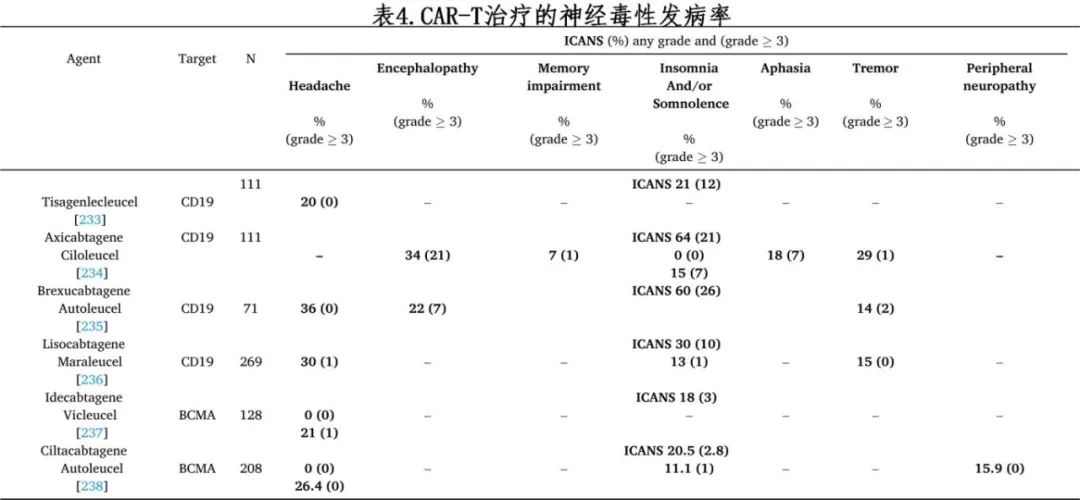
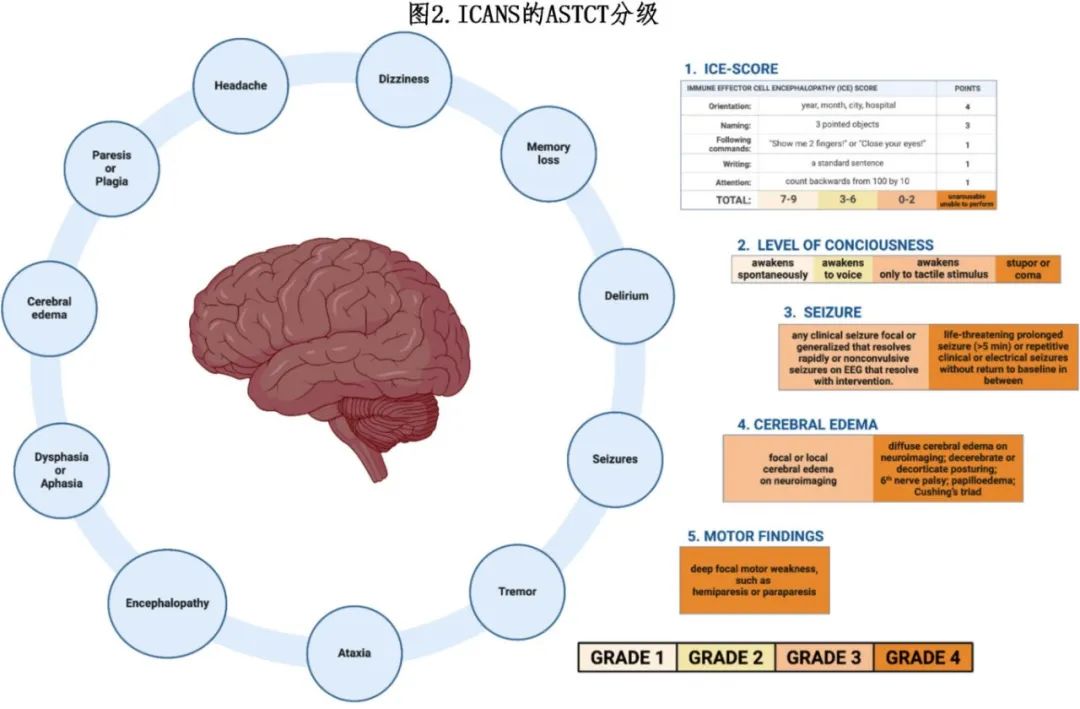
超过半数 CAR-T 细胞受者在输注后 4-10 天出现神经症状,症状通常持续 14-17 天。ICANS 引起的神经毒性与炎症细胞因子水平升高有关,如粒细胞-巨噬细胞集落生长因子(GM-CSF)和白细胞介素 1、6 和10(IL-1、IL-6 和 IL-10)。ICANS 的其他潜在机制包括巨噬细胞和内皮细胞的激活、周细胞的损伤以及血脑屏障通透性的增加。血清 C 反应蛋白、铁蛋白、D-二聚体或促炎性细胞因子水平高的患者发生 ICANS 的风险增加。ICANS 的表现从轻度神经系统症状到急性中毒性脑病不等;很少进展为死亡。症状通常始于找词困难,可能恶化为失语、精细运动障碍、意识模糊、震颤和共济失调。严重病例也报告有脑水肿。ICANS 常伴有细胞因子释放综合征(CRS)的症状。ICANS 的严重程度通过使用多个分级量表进行评分,如 10 分免疫效应细胞脑病(ICE)评分和美国移植与细胞治疗学会(ASTCT)分级(图 2)。
BiTE 抗体贝林妥欧单抗发生神经毒性的风险最高,可能是由于神经元表达 CD19,但 ICANS 通常可逆。轻度神经系统症状不需要任何干预,重度 ICANS 通常用皮质类固醇治疗,但尚无随机对照试验证明其疗效。地塞米松比其他皮质类固醇更有效地穿过血脑屏障。对于重度 ICANS有时会给予鞘内皮质类固醇。托珠单抗治疗在 ICANS 中似乎无效。其他未经证实的针对难治性ICANS的干预措施包括 JAK 抑制剂、酪氨酸激酶抑制剂(如达沙替尼或伊布替尼)、抗胸腺细胞球蛋白(ATG)和环磷酰胺。利培酮可用于治疗癫痫发作,但不建议预防性使用;其他抗癫痫药物(如拉莫三嗪和苯妥英钠)可用于难治性癫痫发作;加巴喷丁有时用于神经病变。在这种情况下,预防性使用托珠单抗可能会增加 ICANS 的风险,因此不建议。相比之下,anakinra预防可降低CRS和 ICANS 的风险;需要进一步研究anakinra预防效果。
造血干细胞移植
荟萃分析报告称,移植后神经毒性的发生率为 6.2%,但另一项研究报告称其发生率仅为 3.9%;约 70%-90% 影响中枢神经系统。至发病的中位时间约为4个月,晚期神经毒性的发生率略高于早期(53%)。神经毒性与预后不良有关,20%的患者在神经症状诊断后不久死亡,另有20%的患者长期、不可逆地出现神经功能障碍。有神经症状的患者5年总生存率为21%,无神经症状的患者为41%(p<0.0001)。神经毒性最常见的病因包括弓形虫引起的急性感染性脑炎、急性自身免疫性脑炎、急性药物相关(主要是钙调神经磷酸酶抑制剂)脑病和脑血管综合征。神经病变和肌病是最常见的外周神经系统表现,均与不良预后无关。
尽管只有约 4%的患者会出现神经毒性,但造血细胞移植受者患可逆性后部脑病综合征(PRES)的风险尤其高。PRES 是一种脑血管的小血管微血管病变,特征为头痛、视力障碍(包括视野缺损和皮质盲)、意识模糊、癫痫发作和昏迷,可发生于严重高血压、肝脏疾病、自身免疫性疾病、血栓性血小板减少性紫癜(TTP)、肾衰竭和肝功能衰竭以及先天性或药物诱导的免疫抑制的情况下;罕见情况下PRES也会发生于化疗(如甲氨蝶呤或 R-CHOP)后,可急性或亚急性发作。T2 加权磁共振成像通常显示顶叶-颞叶区域的灰质和白质有短暂的高信号病变。通常在停止治疗并处理癫痫发作和电解质失衡后的几天内就会缓解,目前尚无经证实有效的治疗方法。
儿童人群中的神经毒性
本文关注成人神经毒性,大多数毒性和其管理在成人和儿童之间相当,因此不会在此详细描述,仅简要地强调在儿科人群中观察到的一些关键差异,儿童血液肿瘤的神经毒性超出本文范围。儿童治疗相关神经毒性可参考Phillips NS, Duke ES, Schofield HT, Ullrich NJ. Neurotoxic effects of childhood Cancer therapy and its potential neurocognitive impact. J Clin Oncol 2021;39 (16):1752–65.。
在儿童中,与成人一样,急性毒性在治疗的早期几个月最为常见,癫痫发作和运动障碍是主要症状。在儿童急性淋巴细胞白血病中,近半数患者出现了甲氨蝶呤诱导的白质脑病,其次是中心静脉窦血栓形成(继发于 L-门冬酰胺酶或皮质类固醇)和声带麻痹(继发于长春新碱)。一岁以下儿童和唐氏综合征患者似乎特别容易发生声带麻痹。一项纳入 1500 名急性淋巴细胞白血病患儿的新研究报告称,神经毒性发生率为 9%,其中 PRES 最为常见,其次是静脉血栓形成和甲氨蝶呤诱导的白质脑病。这两项研究都强调,在治疗的前六个月,中枢神经系统毒性和血栓形成的风险增加,尤其是在≥10 岁儿童中。儿童人群特有的关键问题在于高风险的长期神经心理学和发育并发症,幸存者经常出现工作记忆、注意力持续时间和智商(IQ)受损的情况。
总结
血液肿瘤中化疗和免疫治疗相关的神经毒性很常见,准确诊断有时具有挑战性,但由于与合并症和同步干预措施的混淆,归因更是困难重重。本文强调了不同药物引起神经毒性的不同类型和严重程度,从头痛和头晕等轻度症状到脑病和癫痫发作等严重情况。在少数情况下,毒性机制是已知的或假设的,但一般都为未知。这些不同的神经不良事件的病理生理学基础仍不完全理解,需要更多的研究。预防、早期识别和管理这些毒性需要多学科方法,重点是识别和减轻原因。使用临床评分,如ICANS的ASTCT分级或改良早期预警评分(MEWS)可能有助于识别有神经功能恶化风险的患者。MEWS将格拉斯哥昏迷量表作为神经状况的评估标准。Mews 评分在 6 分或更高与重症监护病房(ICU)入院率更高、治疗期间并发症发生率更高以及死亡率更高有关。通常来说,对肿瘤治疗相关不良影响的管理只是对症治疗,而不解决其病因或发病机制。
参考文献
David Kegyes et al., Blood Reviews, https://doi.org/10.1016/j.blre.2024.101254
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)