首页 > 医疗资讯/ 正文
氨基酸是构成蛋白质的基本组成单位,也是人体组织的重要构成部分,扮演着细胞信号传导、酶活性调节、免疫功能等多种生理功能的角色。不同的生理病理状态,如生长、发育、疾病或应激等,细胞内的氨基酸丰度常发生变化。因此,机体如何感应氨基酸水平变化并做出适应性反应是代谢应激与细胞命运的重要科学问题。氨基酸感应异常与癌症、糖尿病、神经退行性疾病及衰老过程密切相关。因此,探究氨基酸感应异常的分子机制可能为预防或治疗代谢性疾病和癌症提供了新的靶标。既往研究揭示了以 GCN2 和 mTORC1 途径为核心的氨基酸感应机制及其调控细胞内蛋白合成的进程。然而,一些氨基酸也发挥了非蛋白合成的重要功能。因此,是否存在独立于 GCN2 和 mTORC1 途径的特异性氨基酸感应机制,以及特定氨基酸感应体系是否参与蛋白合成以外的生物学功能仍是领域内亟待解决的重要科学问题。
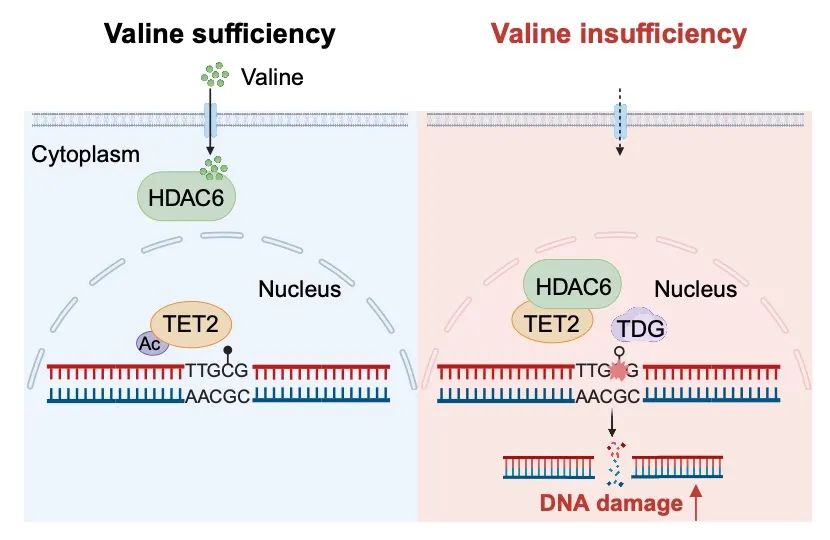
2024 年 11 月 20 日,同济大学医学院/附属第十人民医院团队王平在 Nature 杂志在线发表了题为 Human HDAC6 senses valine abundancy to regulate DNA damage 的研究论文。研究团队发现了一个全新的缬氨酸特异性感应器——人源去乙酰化酶 HDAC6,并揭示了缬氨酸限制导致 HDAC6 核转位,进而增强 TET2 活性并诱导 DNA 损伤的具体机制。有趣的是,该感应机制是灵长类所特有的,通过进一步的机制解析发现灵长类 HDAC6 含有一段特有的富含丝氨酸-谷氨酸十四肽(SE14)重复结构域并通过该结构域感应缬氨酸丰度。缬氨酸限制本身或联合 PARP抑制剂,可有效抑制肿瘤生长。
有趣的是,该感应机制是灵长类所特有的,通过进一步的机制解析发现灵长类HDAC6含有一段特有的富含丝氨酸-谷氨酸十四肽(SE14)重复结构域并通过该结构域感应缬氨酸丰度。肿瘤治疗方面,适度的缬氨酸限制或联合PARP抑制剂,可有效抑制肿瘤生长。
本研究揭示了营养应激通过表观遗传修饰调控DNA损伤的全新机制,并提出缬氨酸限制性饮食联合PARP抑制剂治疗肿瘤的新策略。

氨基酸感应器通常需要结合氨基酸才能识别和响应细胞内外氨基酸的浓度变化,从而发挥其感应功能。
为系统性鉴定缬氨酸的结合蛋白,研究人员使用生物素化修饰的缬氨酸探针进行免疫共沉淀实验并结合质谱分析,利用化学生物学无偏差筛选得到缬氨酸结合蛋白。
作者发现,除已知的缬氨酰tRNA合成酶(VARS)外,去乙酰化酶HDAC6相较于VARS,显示出更强的d缬氨酸结合能力。作者通过同位素结合实验、等温滴定量热(ITC)实验及热漂移等实验进一步确定了HDAC6能够直接结合缬氨酸,其亲和力为Kd ≈ 2 μM。解析感应蛋白识别氨基酸的结构特征,有助于深入理解细胞感应氨基酸丰度变化的分子机制。作者通过分析缬氨酸类似物的结合实验发现,HDAC6识别缬氨酸的羧基端和侧链,并能够容忍氨基端修饰。此外,在HDAC6敲除细胞中,缬氨酸限制对mTOR信号通路的调控较对照组无明显差异,提示这一结合区别于传统的氨基酸感应信号通路。
为了探究HDAC6感应缬氨酸的重要结构域及其功能。作者进一步通过HDAC6截短体结合实验,确定HDAC6通过其SE14结构域与缬氨酸发生结合。令人惊讶的是,作者通过同源性比对发现,SE14结构域仅在灵长类的HDAC6中出现。有别于灵长类(人和猴子)的HDAC6,鼠的HDAC6并不能与缬氨酸发生结合。这一发现揭示了不同物种在缬氨酸感应中的差异性,提示了物种进化在氨基酸感应中的重要作用。
基于HDAC6通过其SE14结构域直接结合缬氨酸这一结论,作者推测当细胞内缬氨酸丰度发生变化时,HDAC6与缬氨酸结合强弱的变化很有可能影响其结构与功能。通过一系列的实验探究并结合文献中关于SE14结构域在HDAC6的胞质滞留中发挥的重要作用,作者发现,细胞内缬氨酸的匮乏能够诱导HDAC6转位至细胞核,其酶活区域(DAC1和DAC2)与DNA羟甲基化酶TET2的活性区域(CD结构域)发生结合,促进TET2发生去乙酰化,进而激活其酶活性。作者通过WGBS、ACE-Seq和MAB-Seq等甲基化组学技术,进一步证实了细胞内缬氨酸饥饿能够通过HDAC6-TET2信号轴,促进DNA主动去甲基化。此前André Nussenzweig研究团队发现胸腺嘧啶DNA糖基化酶(TDG)依赖的DNA主动去甲基化会在神经元增强子上产生DNA单链损伤。作者通过TET2 ChIP-Seq结合检测DNA损伤的高通量测序技术END-Seq和ddC S1 END-Seq等实验方法,确定缬氨酸匮乏促进DNA损伤。缬氨酸匮乏诱导的DNA损伤同样也依赖于TDG切除氧化甲基胞嘧啶(5fC/5caC)所产生的单链损伤。
综上,作者发现了全新的缬氨酸感应器,并首次阐明了缬氨酸限制通过HDAC6-TET2-TDG信号轴诱导DNA损伤的分子机制,为理解氨基酸应激在细胞命运决定中的功能增加了一个新的维度。
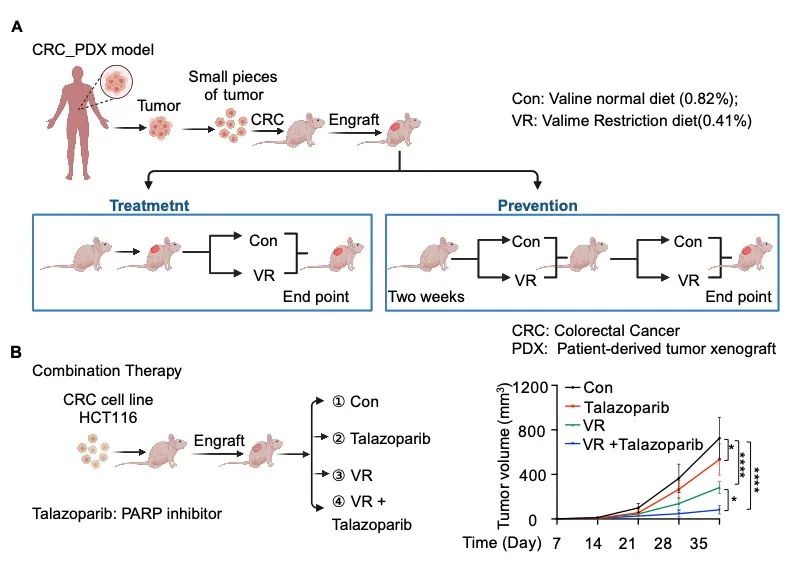
饮食限制或者靶向氨基酸代谢和感应已成为延长寿命和癌症等多种疾病治疗的辅助策略。鉴于缬氨酸剥夺能够诱发DNA损伤,作者进一步研究了缬氨酸限制是否在癌症治疗中发挥作用。在结直肠癌异种移植瘤模型中,适宜的缬氨酸限制饮食(0.41%缬氨酸,w/w)可显著抑制肿瘤生长,同时副作用较小。在预防组和治疗组中,作者利用结直肠癌PDX模型进一步证实了限制缬氨酸饮食抑制肿瘤发生与发展。在肿瘤样本中,缬氨酸水平的降低与HDAC6核易位、5hmC水平和DNA损伤程度的增加呈正相关。由于诱导DNA损伤是一种抗癌疗法,在临床上可以通过使用PARP抑制剂阻断DNA修复。作者发现缬氨酸限制性饮食和PARP抑制剂talazoparib联合治疗显著增强抗肿瘤效果,为该疗法通过诱导DNA损伤治疗癌症提供了有力的证据。
总之,该研究发现灵长类动物的HDAC6是一种不依赖于传统感应器的全新缬氨酸感应蛋白,揭示不同物种在缬氨酸感应中的差异性,表明生物进化在氨基酸感应中的重要作用。
此外,本研究阐明了营养代谢应激、表观遗传调控与DNA损伤交互调控的新机制,拓宽了营养代谢应激在应激生物学中的重要性,并发现缬氨酸限制性饮食与PARP抑制剂联合应用可作为癌症治疗的新策略。
同济大学医学院/附属第十人民医院王平教授为本论文的通讯作者。同济大学金佳丽、孟通、俞媛媛和中国科学院分子细胞科学卓越创新中心吴树恒为该论文共同第一作者。该研究得到了同济大学生命科学学院江赐忠教授、中国科学院分子细胞科学卓越创新中心吴薇研究员、耶鲁大学吴殿青教授、同济大学医学院袁健教授、同济大学生命科学学院薛剑煌教授/王子昕、华东师范大学陈益华教授和沈阳药科大学曹昊教授等团队的合作和支持。
原文链接: https://doi.org/10.1038/s41586-024-08248-5- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)