首页 > 医疗资讯/ 正文
在过去的几十年里,活性氧(ROS)在生物系统中的作用经历了从被视为有害副产物到被认可为重要调控因子的转变。最初,由于ROS的高反应性和对生物分子的潜在损伤作用,ROS曾被简单地认为是细胞代谢的有害副产品。然而,随着研究的深入,我们现在知道ROS在所有生物体的生存和健康中起着至关重要的作用,参与调节几乎所有的生物过程。在生理水平下,ROS能够调节重要的信号通路和生化反应。
在进化过程中,细胞不断暴露于内源性和外源性的ROS,并发展出复杂的调控机制,以维持氧化还原稳态,从而在压力环境下生存并利用ROS促进细胞增殖。然而,氧化还原稳态的破坏会导致细胞应激和疾病的发生,其中,癌症是与氧化应激密切相关的主要疾病之一。癌细胞中的ROS水平往往异常升高,这种失衡不仅影响肿瘤的发展和进展,还与癌症免疫和代谢的调控密切相关。近年来,关于ROS在癌症中的复杂角色、氧化还原信号与癌症代谢的机制联系及其对癌症免疫的影响,以及基于ROS的癌症治疗方法方面取得了重大进展。
2024年7月9日,中山大学肿瘤防治中心的黄蓬课题组在Nature Reviews Drug Discovery期刊上发表了一篇名为:Targeting ROS in cancer: rationale and strategies的综述。该论文第一作者是中山大学肿瘤防治中心的Christophe Glorieux。本文综述了ROS在癌症治疗领域的最新研究进展,重点讨论了关键分子参与者、信号通路,以及针对ROS的癌症治疗的新策略和化合物。同时,还探讨了该领域的主要争议,如抗氧化剂在癌症治疗中的矛盾作用、研究方法的缺陷及其潜在解决方案。

癌症中的氧化还原信号传导
文章首先探讨了ROS在癌症中的氧化还原信号传导机制及其在癌症代谢、免疫、相分离、干细胞、细胞命运和癌症相关疾病(如炎症和恶病质)中的复杂作用。具体内容包括:
1. ROS的化学性质及其在信号传导中的作用:ROS能够迅速修饰生物分子,导致其结构、定位、分子间相互作用和功能的变化,特别是过氧化氢(H2O2),由于其能够穿过膜且具有较长的半衰期,成为重要的信号分子。ROS介导的信号传导主要发生在翻译后水平,影响转录因子和表观遗传学,从而传递氧化还原信号。
2. ROS介导的翻译后信号传导:ROS通过修饰红氧敏感残基(如半胱氨酸或蛋氨酸)直接影响其靶蛋白的功能。半胱氨酸的氧化可以调节信号传导,通过改变蛋白质功能、定位和促进蛋白质降解。蛋氨酸的可逆氧化和还原也在某些信号传导过程中起调控作用。
3. ROS对转录的调控:ROS通过翻译后修饰红氧敏感转录因子来影响mRNA和非编码RNA(ncRNA)的转录。ROS还可以通过表观遗传修饰影响基因表达,例如影响组蛋白乙酰化和DNA甲基化。
4. ROS对癌症代谢的影响:癌细胞通常表现出更活跃的有氧糖酵解和较慢的三羧酸(TCA)循环代谢。ROS可以通过氧化关键代谢酶或通过红氧敏感信号通路直接影响糖酵解。尽管线粒体呼吸较低,但癌细胞仍依赖TCA循环和氧化磷酸化来获取能量和代谢中间体。
5. ROS在癌症炎症和恶病质中的作用:癌细胞与基质或免疫细胞的相互作用刺激细胞因子释放,导致慢性炎症和免疫抑制细胞的招募,进而影响肿瘤微环境(TME)。ROS还与癌症相关的炎症和恶病质密切相关,影响患者的生活质量和治疗耐受性。
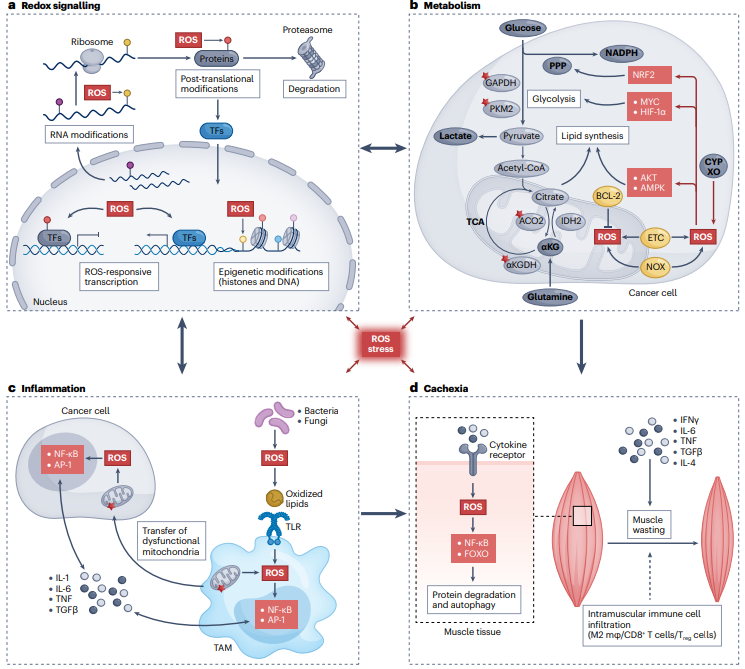
图1:ROS介导的信号传导过程、与代谢的相互作用及其对肿瘤微环境和免疫功能的影响。
ROS在癌症免疫中的作用
接着,文章讨论了ROS在癌症免疫中的作用,以及它们对免疫系统的多方面影响,强调了ROS浓度依赖性的双重作用:既可以刺激也可以抑制免疫反应。内容涵盖了以下几个方面:
1. 红氧介导的免疫刺激:
- ROS,如超氧阴离子(O2•−)、H2O2和羟基自由基(HO•),在刺激先天免疫和适应性免疫反应中起重要作用。T细胞受体(TCR)被激活后,T细胞的线粒体氧化磷酸化和NADPH氧化酶(NOXs)被激活,导致ROS生成增加,这些代谢变化可以增强T细胞增殖和白细胞介素的产生。
- ROS可以上调芳香烃受体(AhR)以促进效应T细胞向记忆T细胞的转变。
- 反应性氮种类(RNS)和反应性硫种类(RSS)也通过不同机制调节免疫细胞功能。
2. 红氧介导的免疫抑制:
- 过量的ROS积累会对免疫功能产生负面影响。癌细胞和免疫抑制细胞(如髓样来源的抑制细胞和调节性T细胞)可以释放高水平的ROS和细胞因子(如TGF-β和IL-10),抑制T细胞反应。
- ROS可以通过氧化关键免疫调节分子、诱导癌细胞中的免疫检查点分子和选择免疫抑制细胞,直接或间接地抑制免疫细胞。
3. ROS在肿瘤与免疫细胞之间的对话中的作用:
- 肿瘤细胞通过消耗营养物质和产生有毒代谢产物(如乳酸和腺苷)对免疫细胞产生负面影响。
- 某些代谢产物(如胱氨酸)可以从基质细胞转运到肿瘤微环境中,为癌细胞提供生存优势。
- 在肿瘤与免疫细胞的相互作用中,ROS通过改变脂质过氧化状态、氧化脂质的转运和免疫细胞的代谢重编程,抑制抗肿瘤免疫反应。
4. 通过红氧调控增强肿瘤免疫:
- ROS调控策略在癌症治疗中的应用需要谨慎。适度增加ROS可以增强免疫细胞功能,而过量的ROS会对免疫细胞产生不利影响。
- 抗氧化剂的使用需要考虑不同细胞类型和亚细胞区室的抗氧化特性和补偿机制。
- 化疗药物对免疫细胞的影响也需进一步研究,以找到最佳的治疗组合以改善免疫治疗效果。
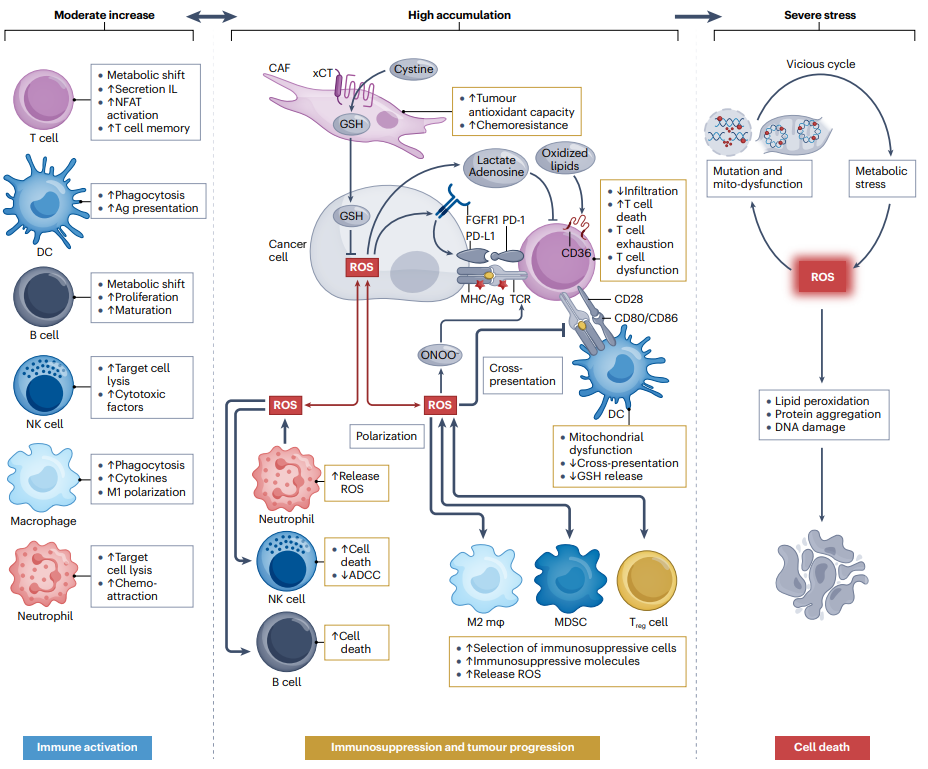
图2:ROS对癌细胞和免疫细胞功能的剂量效应。
ROS在相分离中的作用
接着,文章讨论了ROS在相分离过程中的作用。相分离是指大分子在均相阶段分离成稠密相和稀薄相的热力学过程,导致涉及分子的浓度和运动性发生显著变化。
1. 相分离及其生物学意义:
- 相分离是细胞内无膜细胞器形成的基础,与感应和响应压力、隔离生化反应、机械调节和信号转导等重要细胞过程相关。
- 相分离的形成和溶解可以快速且可逆地感应环境变化,包括ROS生成引发的变化。
2. 红氧介导的相分离:
- ROS通过蛋白质的翻译后修饰(PTM)来介导相分离。例如,H2O2可以通过可逆氧化蛋白质中半胱氨酸的巯基,介导相分离,从而使细胞能够快速响应氧化还原状态。
- H2O2诱导蛋白质中蛋氨酸残基的氧化可以导致液滴状凝聚体的解组装,并且这种过程可以通过蛋氨酸亚砜还原酶恢复。
3. p62小体和KEAP1-NRF2通路:
- p62/Sequestosome-1(SQSTM1)与泛素化蛋白结合,并通过相分离形成p62小体,这与自噬激活相关。在ROS压力下,p62小体会隔离KEAP1并释放NRF2,以促进抗氧化基因的表达。
4. 应激颗粒和加工体:
- ROS可以诱导应激颗粒(SG)的形成,以防止翻译并减少错误折叠蛋白的积累。然而,H2O2可以通过氧化SG核蛋白TIA1的Cys36残基抑制SG的组装,从而触发细胞凋亡。
- ROS诱导的RNA氧化损伤被识别并隔离在SG中进行降解,而加工体与SG相互作用,将氧化的RNA转移到加工体中进行降解。
5. 脂滴:
- 在氧化应激下,脂滴可以作为抗氧化细胞器,吸收细胞膜中的多不饱和脂肪酸,防止膜过氧化。
- 在某些细胞类型中,脂滴的积累会导致ROS水平升高并干扰氧化还原平衡,可能导致炎症和功能失调状态。
6. 糖酵解颗粒(G body):
- 在低氧状态下,肝癌细胞可以形成含有高浓度糖酵解酶的非膜结合颗粒,称为G bodies。无法形成G bodies的细胞在低氧下显示出增加的葡萄糖消耗和降低的糖酵解中间体水平。
7. 相分离的调控和癌症治疗潜力:
- 阐明在生理条件下调节相分离的机制,以及在氧化应激下可能发生的异常相分离,对理解癌症进展具有重要意义。
- “凝集体修饰疗法”是指通过调节特定生物分子凝集体的物理性质、网络、组成、动态和功能,来预防或逆转疾病过程的策略和药物。
- 利用ROS诱导某些红氧敏感分子发生相分离,可能成为癌症治疗的潜在策略。
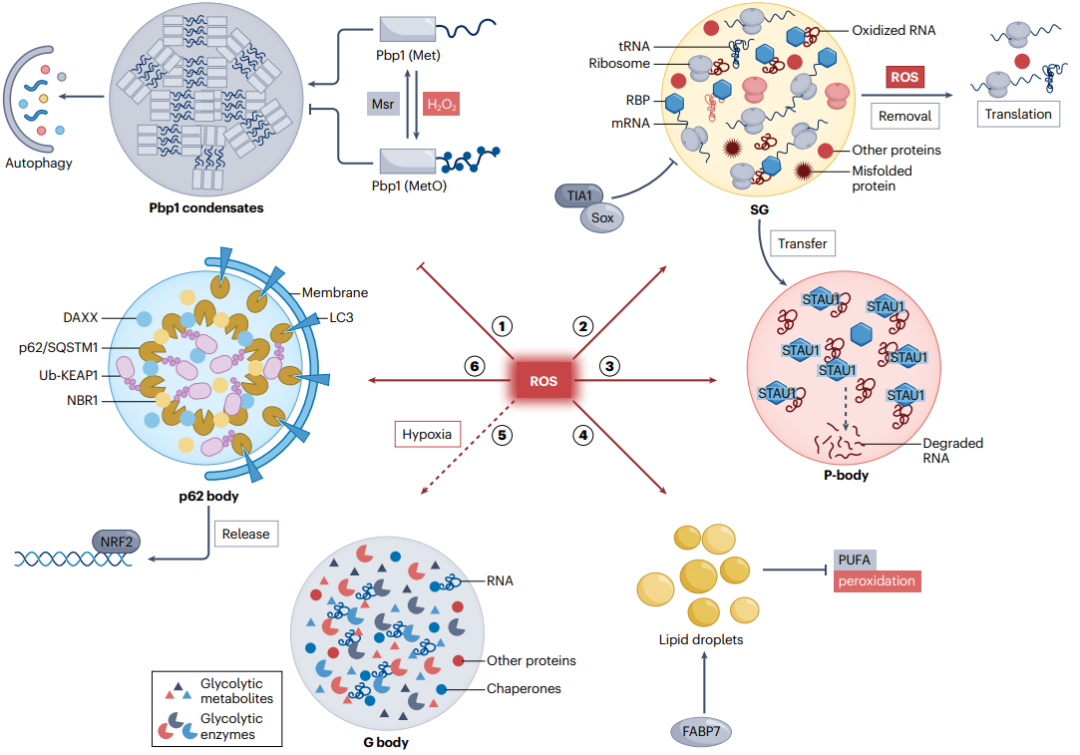
图3:ROS在相分离中的作用。
癌症干细胞中的氧化还原信号传导
文章还讨论了ROS在癌症干细胞(CSCs)中的氧化还原信号传导作用及其在癌症治疗中的潜力。
1. ROS在癌症干细胞中的作用:
- ROS在调节CSCs的可塑性方面起重要作用,影响CSCs适应缺氧、营养缺乏和有害物质(如化学品和辐射)压力的灵活性,这可能导致治疗抗性、转移和癌症复发。
2. ROS对细胞干性(Stemness)的影响:
- 与正常干细胞类似,低水平的ROS对于维持CSCs的干性是必要的,这部分是通过上调抗氧化基因实现的。低ROS水平被认为可以减少氧化性DNA损伤,保持干细胞的基因指纹,维持适当的细胞周期状态,并减少CSCs对辐射的敏感性。
3. ROS在CSCs状态转换中的作用:
- ROS水平的变化对于CSCs在上皮和间质状态之间的可逆转换至关重要,这两个过程在癌症转移中起重要作用。间质样状态相对静止,具有低ROS水平,而活跃的线粒体会产生高水平的ROS,诱导上皮样状态的转换,促进肿瘤在转移部位的生长。
- 上皮样状态的CSCs由于高ROS水平,对NRF2介导的氧化还原适应依赖更大,NRF2不仅通过GSH和TRX通路激活抗氧化反应,还促进药物外排、维持干性和可塑性相关途径的表达。
4. 调节CSCs中的ROS:
- 有效的癌症治疗需要消除CSCs,破坏其氧化还原适应机制可以成为一种有效的方法。例如,通过某些化合物诱导ROS可以导致膀胱癌干性的丧失,减少GSH的合成可以显著减少结直肠癌细胞的侧群并抑制肿瘤形成。
- 组合治疗策略(如PEITC和5-氟尿嘧啶,或阿霉素和埃拉斯汀)可以减少GSH水平,提高ROS,导致癌症细胞和CSCs的消除。
5. ROS消除机制的抑制和氧化还原适应机制的破坏:
- 抑制ROS消除机制和破坏氧化还原适应机制已被证明在抑制转移方面有效。例如,fangchinoline可以诱导NOX4降解,抑制ROS介导的AKT-mTOR通路,从而抑制非小细胞肺癌的上皮-间质转变、侵袭和转移。
- Brusatol作为强效的NRF2抑制剂,可以抑制转移并逆转动物模型中的药物抗性,增强化疗效果。然而,抑制NRF2可能会对正常细胞造成副作用,因此需要仔细调节NRF2抑制剂和化疗-放疗的剂量,以实现良好的组合效果,并进一步减少正常组织的毒副作用。

图4:癌症干细胞中ROS应激适应及其在转移和治疗耐药中的作用。
ROS对细胞命运的影响
接着,文章讨论了ROS在细胞命运调控中的重要作用,特别是它们在不同形式的程序性细胞死亡(RCD)中的作用。以下是内容的主要要点:
1. ROS诱导的细胞死亡类型:
- Ferroptosis(铁死亡):铁依赖性的ROS驱动的非酶或酶介导的脂质过氧化,通过Fenton反应引发脂质过氧化,GSH和GPX4等抗氧化系统对抗铁诱导的ROS和脂质过氧化。
- Pyroptosis(细胞焦亡):由ROS引发的炎症反应强烈的RCD形式,通过炎症小体激活,导致GSDM蛋白的孔形成和促炎细胞因子释放。
- Apoptosis(细胞凋亡):经典的RCD形式,可以通过ROS诱导内在和外在途径,如线粒体释放和死亡受体信号传导复合物(DISC)的形成,来触发。
- Necroptosis(坏死性凋亡):一种非半胱氨酸依赖的受控性细胞死亡,通过ROS诱导的RIP1和RIP3复合物形成,引发细胞膜孔形成和细胞死亡。
- Oxeiptosis(氧化性凋亡):由高水平H2O2诱导的一种新型细胞死亡,介导通过PGAM5磷酸酶促进线粒体相关1(AIFM1)去磷酸化而发生。
- NETosis:ROS诱导的中性粒细胞胞外诱捕网(NET)形成,通过NOX介导的ROS生成和NE活化,促进染色质脱凝和NET形成。
2. ROS在细胞死亡调控中的作用机制:
- 不同细胞类型对ROS的反应决定了它们采取的RCD类型,涉及到细胞内遗传电路、代谢状态以及ROS的水平和类型。
- 这些细胞死亡形式在癌症治疗中可能起到重要作用,通过激活免疫系统等方式对抗肿瘤细胞,但同时也可能与癌症进展和药物抗性相关联。
3. 治疗策略与潜在靶点:
- 对于每种细胞死亡类型,不同的抗氧化系统和分子机制被提出作为潜在的治疗靶点,如GPX4、xCT等。
- 利用这些细胞死亡类型作为癌症治疗的策略可能包括调节细胞死亡的信号通路,或通过引发免疫反应来增强治疗效果。
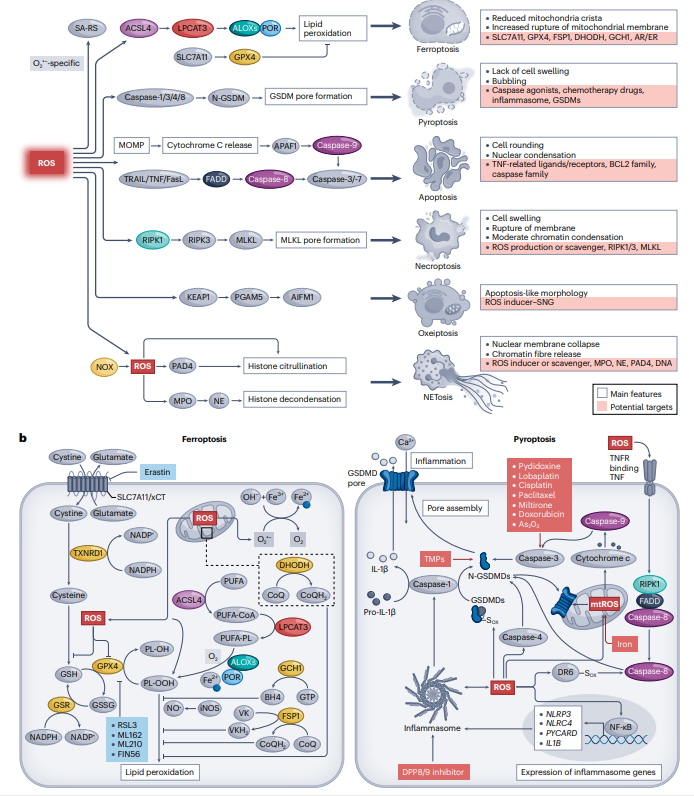
图5:ROS在诱导程序性细胞死亡中的作用。
靶向ROS的癌症治疗策略
文章详细讨论了ROS在癌细胞生存、增殖和死亡过程中的重要作用,以及如何利用这些特性来开发针对癌症的新治疗方法。主要涵盖了两类策略:一是针对ROS生成机制的策略,包括抑制NADPH氧化酶、一氧化氮合成酶、增强细胞内高水平ROS的产生等;二是针对红氧适应机制的策略,主要是通过抑制抗氧化剂系统或其上游调节分子来使癌细胞失去抗氧化适应性,增加其对ROS诱导药物的敏感性。文章还讨论了一些新型ROS靶向抗癌剂,包括纳米粒子介导的热力学和光动力学疗法以及其他直接靶向ROS的策略。
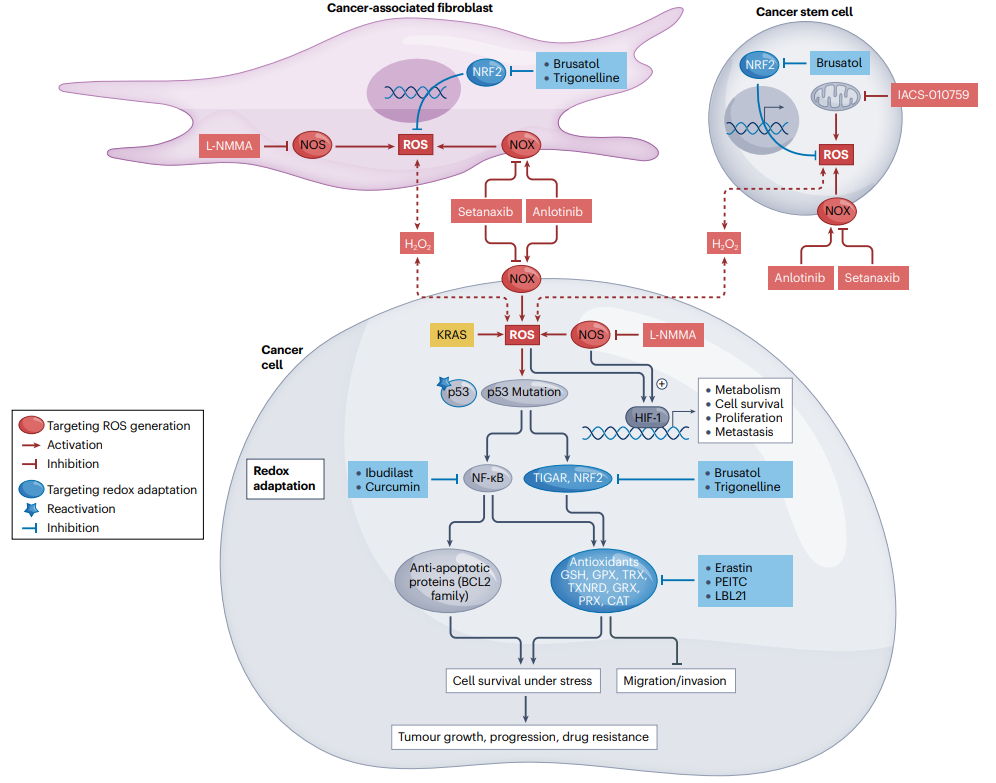
图6:靶向ROS的癌症治疗策略。
总结与未来展望
最后,文章总结了在红氧信号传导、癌症代谢、ROS在调控表观遗传学以及影响mRNA和长链非编码RNA转录中的作用等方面的新发现,这些都深化了对基础红氧生物学的理解,同时提供了癌细胞异常生化过程及其与宿主生物系统相互作用的重要新见解。文章强调了ROS浓度依赖性效应的实现,为解决ROS在不同实验模型中产生不同甚至相反效应的长期悖论提供了合理解释。此外,文章还探讨了通过设计更有效的ROS调节化合物及其与其他治疗方式的合理组合,进一步开发治疗癌症的前景和挑战。
参考文献:
https://doi.org/10.1038/s41573-024-00979-4- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)