首页 > 医疗资讯/ 正文
首次复发AML
急性髓性白血病(AML)患者可根据年龄和合并症情况,接受强化治疗(IT)或低强度治疗(LIT),适合移植患者还建议接受异基因造血干细胞移植(alloSCT)。<60岁患者中约有半数会在首次完全缓解(CR1)后发生复发性AML(rAML),且>60岁患者中比例更高。rAML患者尚无标准治疗,最适合的方案为诱导二次缓解(CR2)及适合移植患者接受alloSCT巩固。但总的来说,rAML患者对挽救性治疗的反应较差,预后不佳。
多个因素影响rAML患者的预后,但既往的相关报道多集中于诊断时的变量,然而事实上,AML细胞复发时可以获得新的遗传病变,并失去诊断时存在的部分基因异常,这是由AML固有的多克隆生物学以及暴露于一线治疗的选择压力引起的。随着新的靶向治疗(即FLT3或IDH1/2抑制剂)的引入,预计富含靶向突变的克隆不太可能在复发时持续存在。
基于此,MD安德森癌症中心学者对大样本rAML患者进行了全面的分析,并对诊断和复发时可用的细胞遗传学和分子学数据进行了分析,以确定基因异常的动力学,并确定预测生存的诊断和复发时因素。结果近日发表于《Haematologica》。

研究结果
该研究为单中心回顾性研究,纳入2017-2022期间诊断的≥18岁AML患者(因MD安德森2017年开始提供81基因二代测序[NGS] panel)。根据ELN 2022指南评估疗效。
基线特征和结局
共纳入875例AML患者。患者年龄中位数为65岁,男性468例(54%)。根据ELN 2022分类,分别有175例(21%)、199例(24%)和470例(56%)为低危、中危和高危组。348例(40%)患者接受IT治疗(144例加用维奈克拉,41%)。527例(60%)患者接受LIT治疗(379例加用维奈克拉, 72%)。101例(12%)患者同时使用FLT3抑制剂,22例(3%)患者同时使用IDH1/2抑制剂,62例(7%)患者同时使用gemtuzumab-ozogamicin (GO),74例(9%)患者同时使用免疫检查点抑制剂。
整个队列的中位随访时间为25个月。大多数患者(637例[73%])达到CR/CRi, 166例(19%)未达到CR/CRi, 72例(8%)在评估缓解前死亡。201例患者在首次CR或CRi期进行了AlloSCT (CR/CRi患者中32%)。随访期结束时,337例患者(CR/CRi患者中53%)存活并处于缓解期 (图1)。
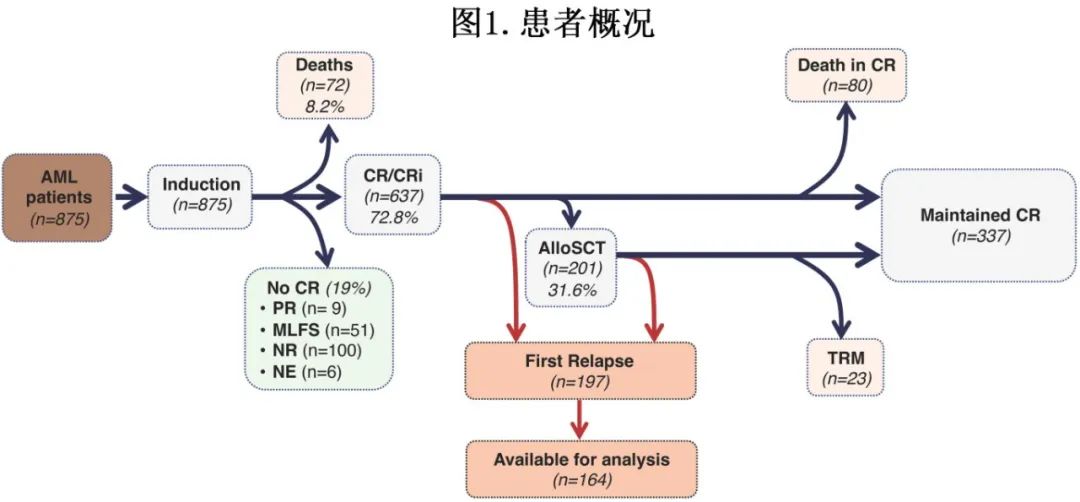
中位OS (mOS)为16.3个月,1年和2年OS率分别为58%和42%。中位EFS (mEFS)为11.9个月,1年和2年EFS发生率分别为50%和37%。IT组患者的mOS高于LIT组患者(52.6 vs 10.8个月,P<0.001)。当按年龄分组比较时,<60岁的患者mOS为52.6个月,≥60岁的患者mOS为12.4个月。ELN22低危、中危、高危组的mOS和mEFS分别为未达到(NA)和NA、 24.1和18个月、11.1和7.8个月(OS和EFS均P<0.001)。
首次复发
在所有分析的患者中,197例患者在CR/CRi后出现疾病复发(CR/CRi患者中31%),其中164例rAML患者具有复发特征和治疗信息。rAML队列诊断和复发时的基线特征详见表1。复发的中位年龄为67岁,其中84例(51%)为男性。诊断根据ELN22分类,24例(15%)、26例(14%)和110例(67%)为低危、中危和高危。
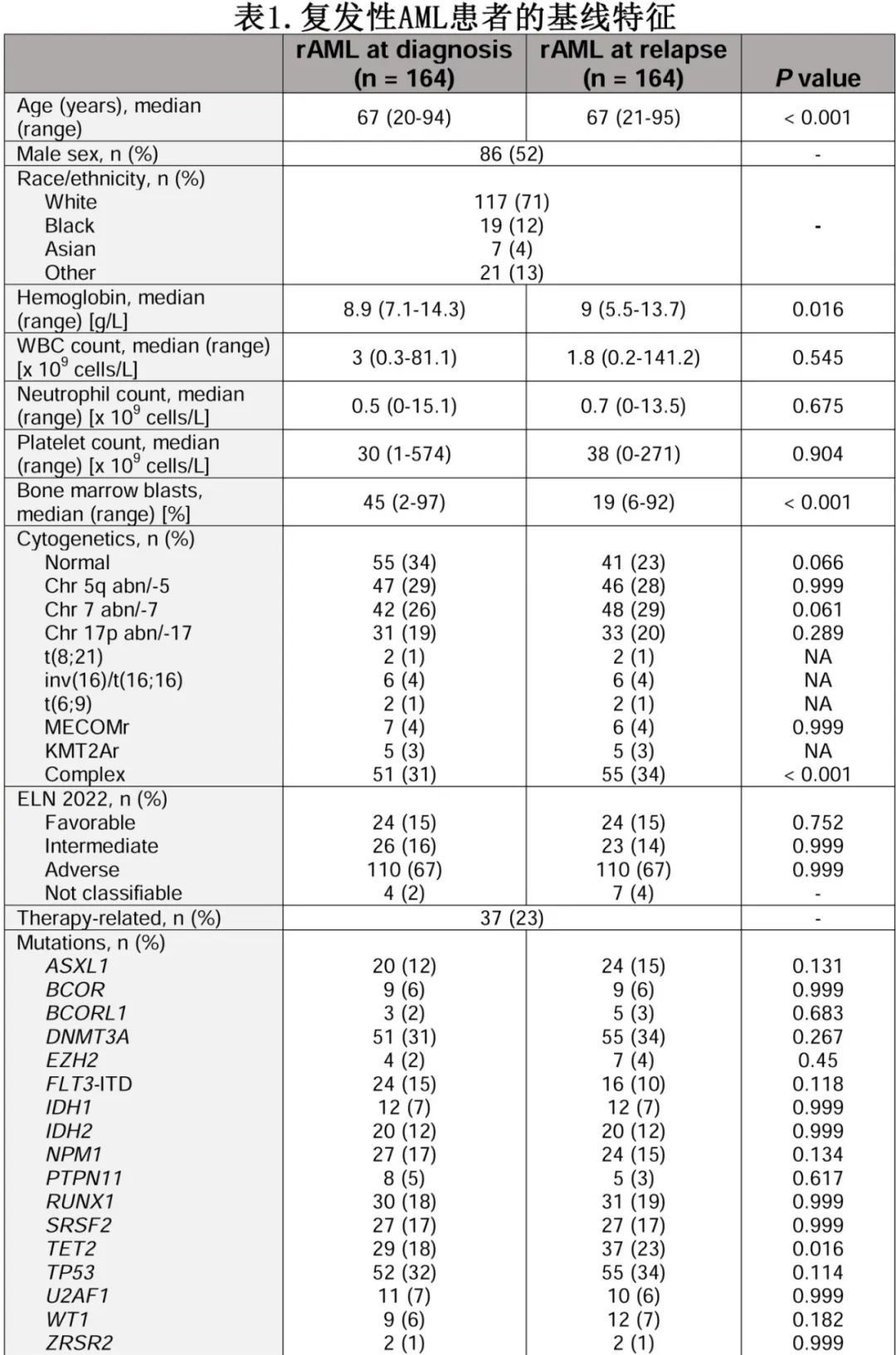
在rAML队列患者中,57例(35%)在诊断时接受IT治疗(16例[10%]使用维奈克拉),107例(65%)接受LIT治疗。51例(89%)患者接受IT治疗达到CR1, 6例(11%)达到CRi;49例(86%)患者在第一个治疗周期后达到最佳疗效。65例(61%)接受LIT治疗的患者达到CR1, 42例(39%)达到CRi;68例(64%)患者在第一个治疗周期后达到最佳疗效。达到CR1后,35例(21%)患者接受alloSCT (IT后20例,LIT后15例)。从最佳缓解到复发的中位时间为6.4个月,IT治疗的患者为7.5个月,LIT治疗的患者为6.1个月 (P=0.7)。
细胞遗传学和突变动力学
首先比较诊断时所有患者队列和rAML患者队列的突变比例和细胞遗传学结果(图2)。诊断时最常见的突变为DNMT3A (n=196[23%])、TP53 (n=183[22%])和NPM1 (n=175[21%]),复发时最常见的突变为DNMT3A (n=55 [35%],P=0.002)、TP53 (n=55[35%],P<0.001)和TET2(n=37[24%] vs 诊断时n=128[15%],P=0.01)。诊断和复发之间的突变率存在显著差异的还包括:RUNX1 (n=99 [12%] vs n=31 [20%],P=0.008)、FLT3TKD (n=112 [13%] vs n=7[5%], P=0.003)、PTPN11 (n=73 [9%] vs n=5[3%],P=0.03)、IKZF1 (n=11 [1%] vs n=7[5%],P=0.02)和KIT (n=31 [4%] vs n=1[1%],P=0.04)。诊断和复发时最常见的细胞遗传学结果为正常核型(n=291 [36%] vs n=41 [27%],p=0.05)、复杂/单染色体核型(n=208 [25%] vs n=55 [36%],p=0.008)、5号染色体异常(n=151 [18%] vs n=46 [30%],p=0.001)和7号染色体异常(n=112 [14%] vs n=48 [32%],p<0.001)。
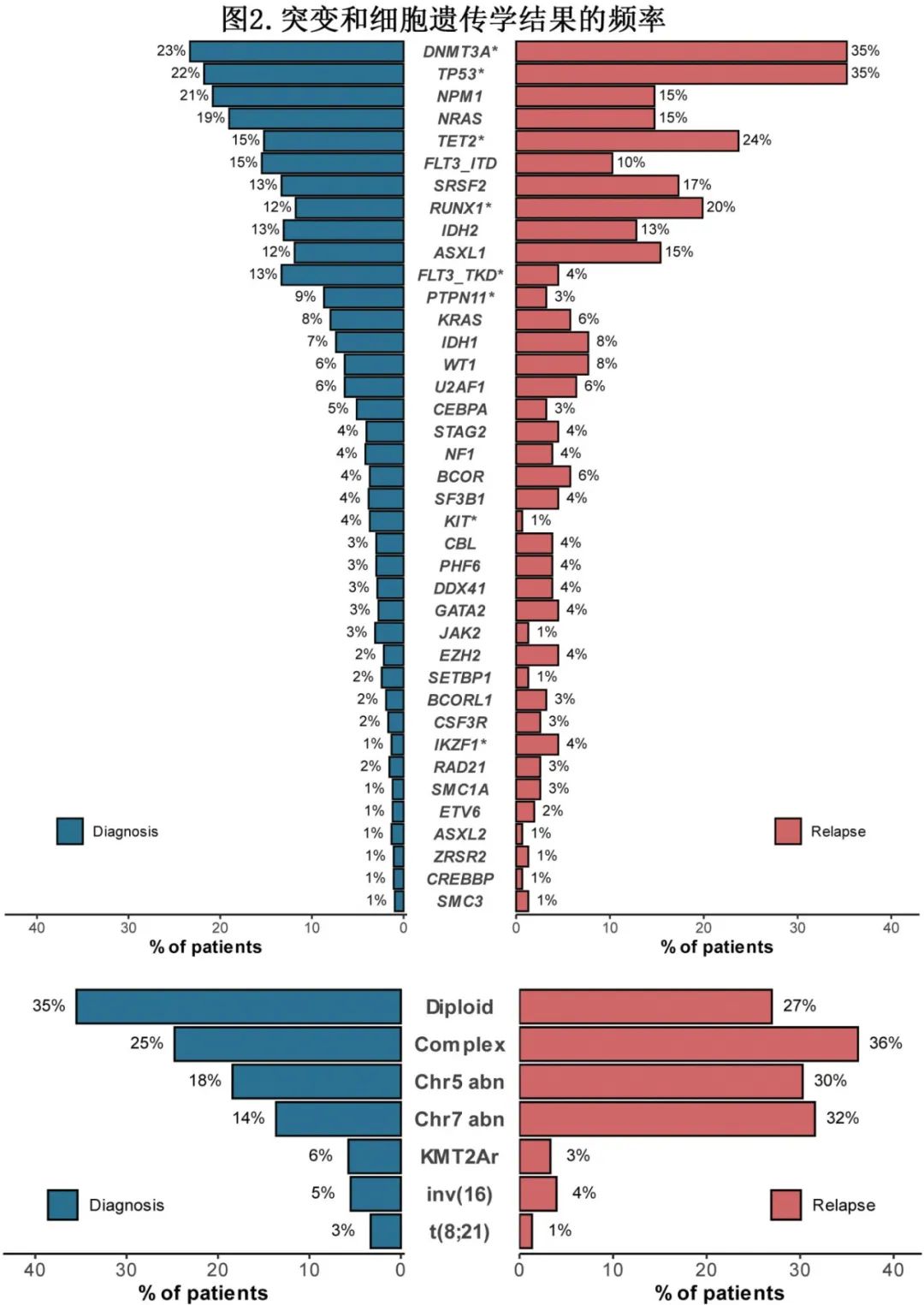
进一步比较了rAML队列患者在诊断和复发时的细胞遗传学和分子学结果(表1)。诊断和复发时的中位突变数分别为3(1-12)和3(1-14)(P=0.07)。诊断时最常见的突变为TP53 (n=52[32%])、DNMT3A (n=51[31%])和RUNX1 (n=30[18%]),分别有55例(34%)和51例(31%)患者存在正常和复杂/单染色体核型。诊断和复发之间的配对比较显示,TET2突变比例(诊断时n=29[18%] vs复发时n=37[23%],P = 0.01)和复杂/单染色体核型(n=51[31%] vs n=55 [34%],P<0.001)有显著差异。在接受IT治疗的患者中,7号染色体异常的比例有显著差异(诊断时n=4[8%] vs 复发时n=10 [20%],P=0.04)。核心结合因子t(6;9)和KMT2A重排在诊断和复发之间保持不变。
分析了诊断和复发之间的突变动力学和细胞遗传学结果(图3)。将复发时清除突变或细胞遗传学结果的患者人数除以诊断时有该突变或细胞遗传学结果的患者人数,计算清除率。与所有其他突变相比,FLT3-ITD(14/24,58%)、FLT3-TKD(11/15,73%)、NF1(6/10,60%)和KIT(3/4,75%)的清除率明显更高。正常核型的转换率也明显较高(14/49,29%),表明29%的二倍体细胞遗传学患者在复发时获得新的细胞遗传学异常。另一方面,DNMT3A(4/ 50,8%)、SRSF2(1/ 27,4%)、TET2(1/28,4%)和TP53(2/49,4%)的清除率明显较低。将复发时获得突变或细胞遗传学结果的患者数量除以诊断时无该突变或细胞遗传学结果的患者数量,计算出现率。复发时出现率显著高的突变有ASXL1(6/137,4%)、DNMT3A(9/106,9%)、EZH2(5/152,3%)、FLT3-ITD(6/132,5%)、NRAS(5/130,4%)、RUNX1(5/126,4%)、TET2(10/128,8%)、TP53(8/107,8%)和WT1(7/149,5%)。与其他细胞遗传学异常相比,7号染色体异常(11/110,10%)和复杂核型(6/100,6%)的出现率显著较高。
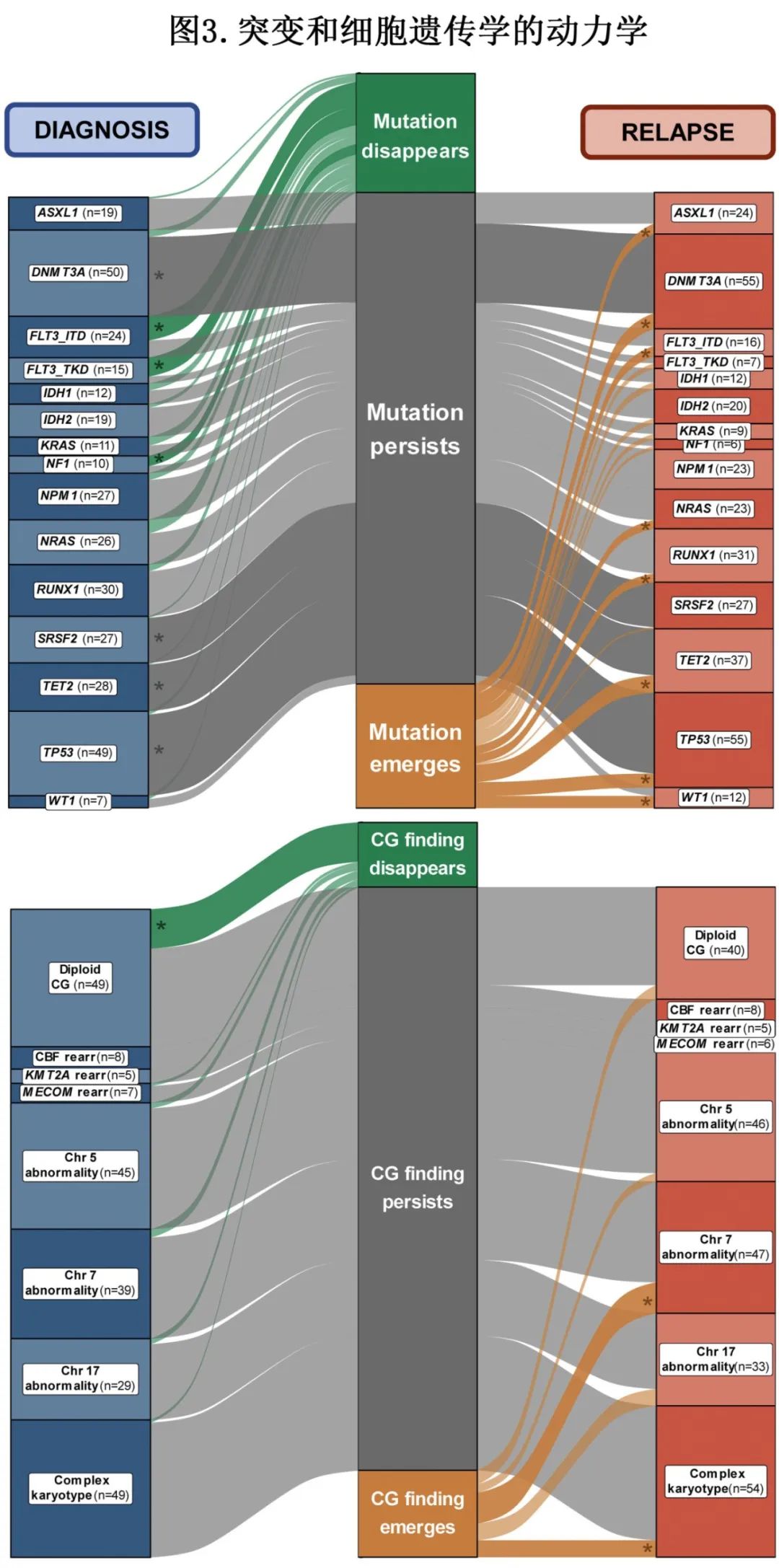
在对不同治疗方案的患者进行比较时,IT组TP53的出现率(7/45,16%)明显高于LIT组(1/62,2%)(P=0.009)。先前异常的细胞遗传学中出现二倍体核型的比率,接受IT治疗的患者(4/29,14%)也显著高于接受LIT治疗的患者(1/71,1%) (P=0.02)(图4)。
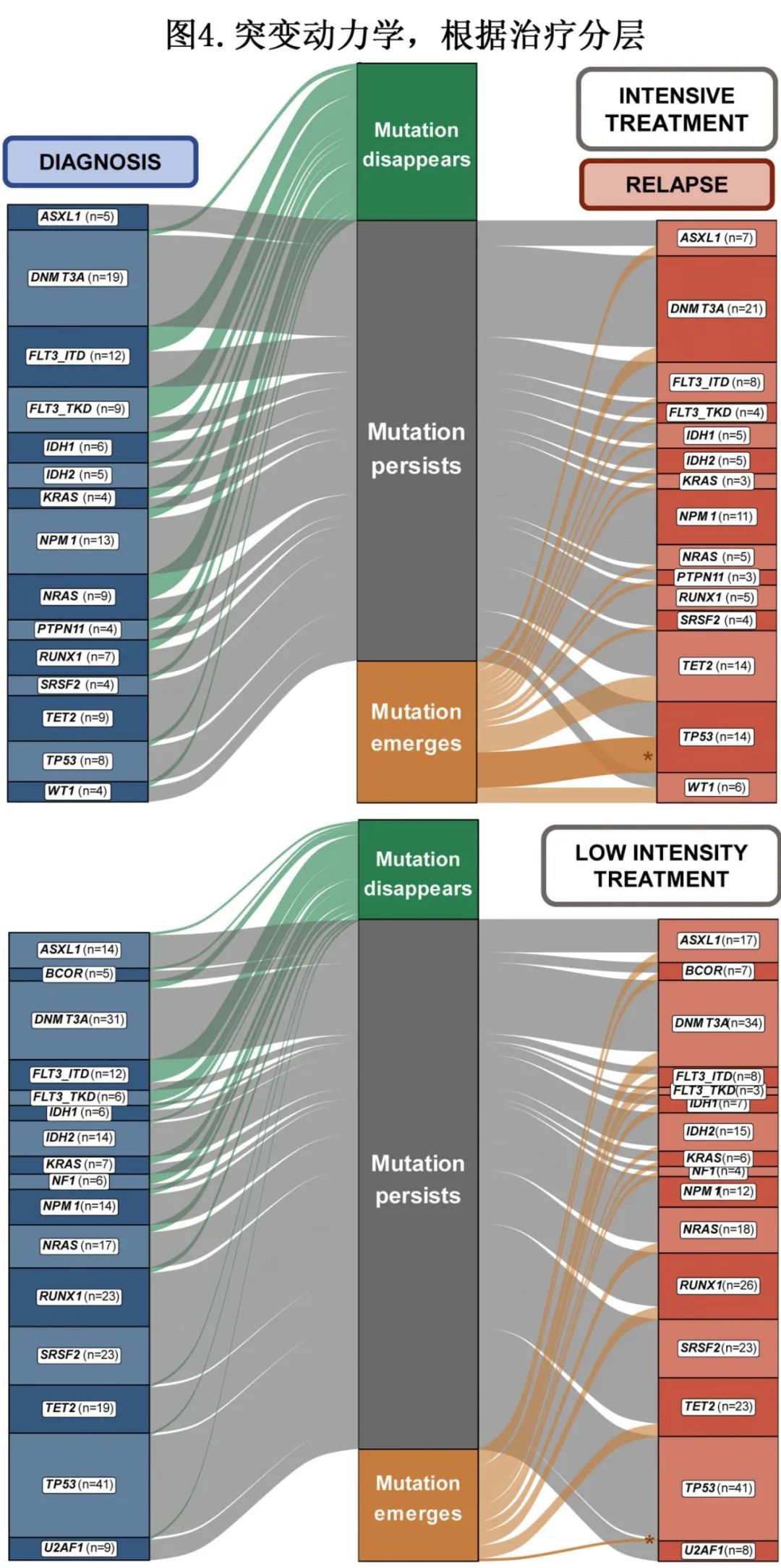
诊断时核型正常的患者(n=55)中,诊断和复发时最常见的突变为DNMT3A(分别为40%和44%)、NPM1(分别为40%和35%)和TET2(分别为33%和35%)。复发时,64%维持正常核型,18%获得其他非特异性细胞遗传学异常,5%获得7号染色体异常,2%获得复杂核型,11%在复发时没有配对核型。
复发后的治疗、缓解率和结局
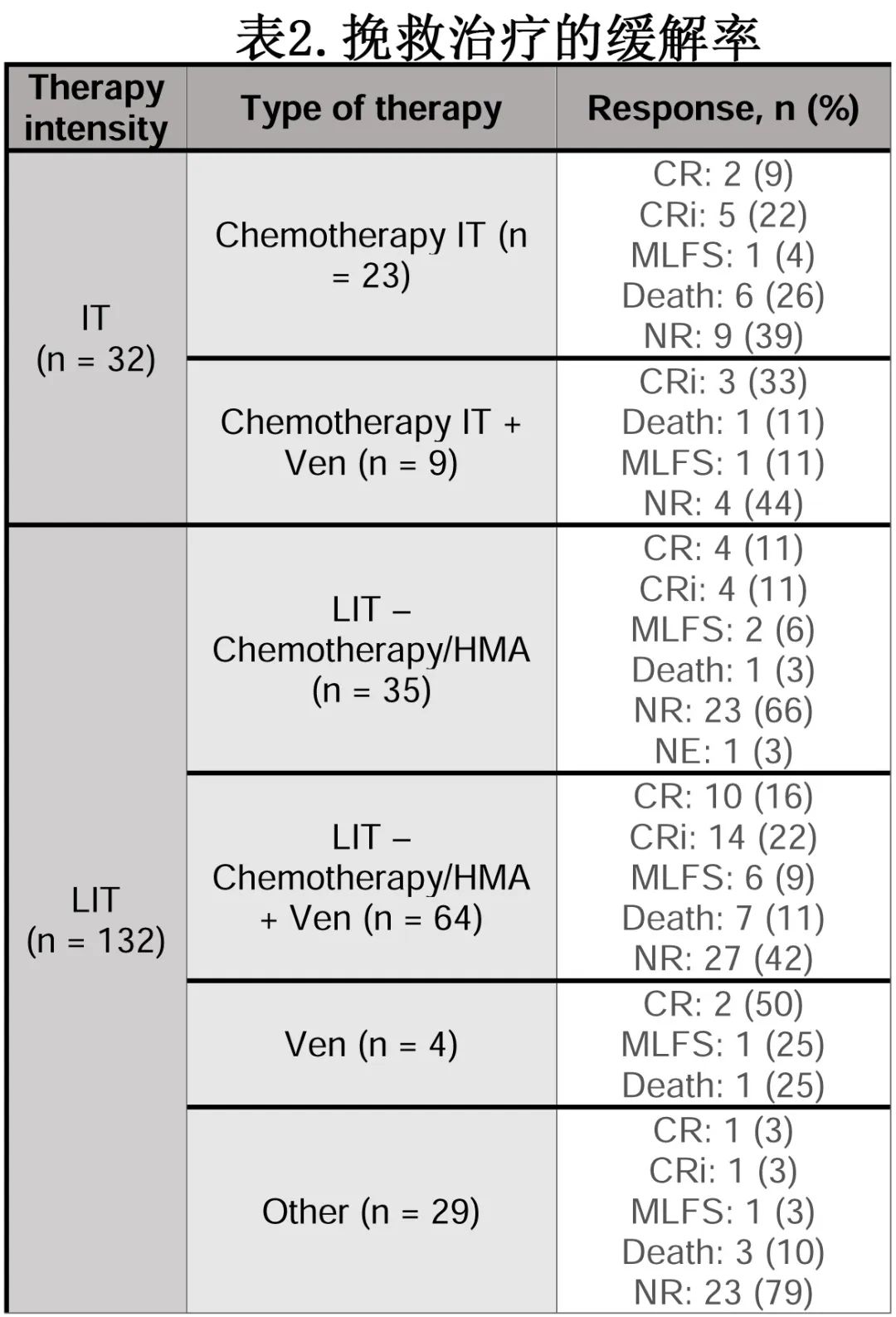
复发时,32例(20%)患者接受挽救性IT (n=9[6%]联合Ven,n=23[14%]不联合Ven), 132例(80%)患者接受挽救性LIT (n=68[41%]联合Ven,n=64[40%]不联合Ven)。此外,18例(11%)患者接受FLT3抑制剂治疗,18例(11%)患者接受IDH1/2抑制剂治疗,12例(7%)患者接受GO治疗,33例(20%)患者接受非GO免疫治疗。接受IT治疗的患者的总体ORR为38%(12/32),联合和不联合维奈克拉患者的ORR分别为44%和35% (P=0.69)。接受LIT治疗的患者ORR为35%(46/132)。在接受LIT化疗(低剂量化疗或去甲基化药物)的患者中,总体ORR为40.4%(40/99),联合和不联合维奈克拉患者的ORR分别为28.6%和46.9% (P=0.09)(表2)。17例患者(10%)接受了alloSCT (n=7[41%]接受第二次alloSCT)。
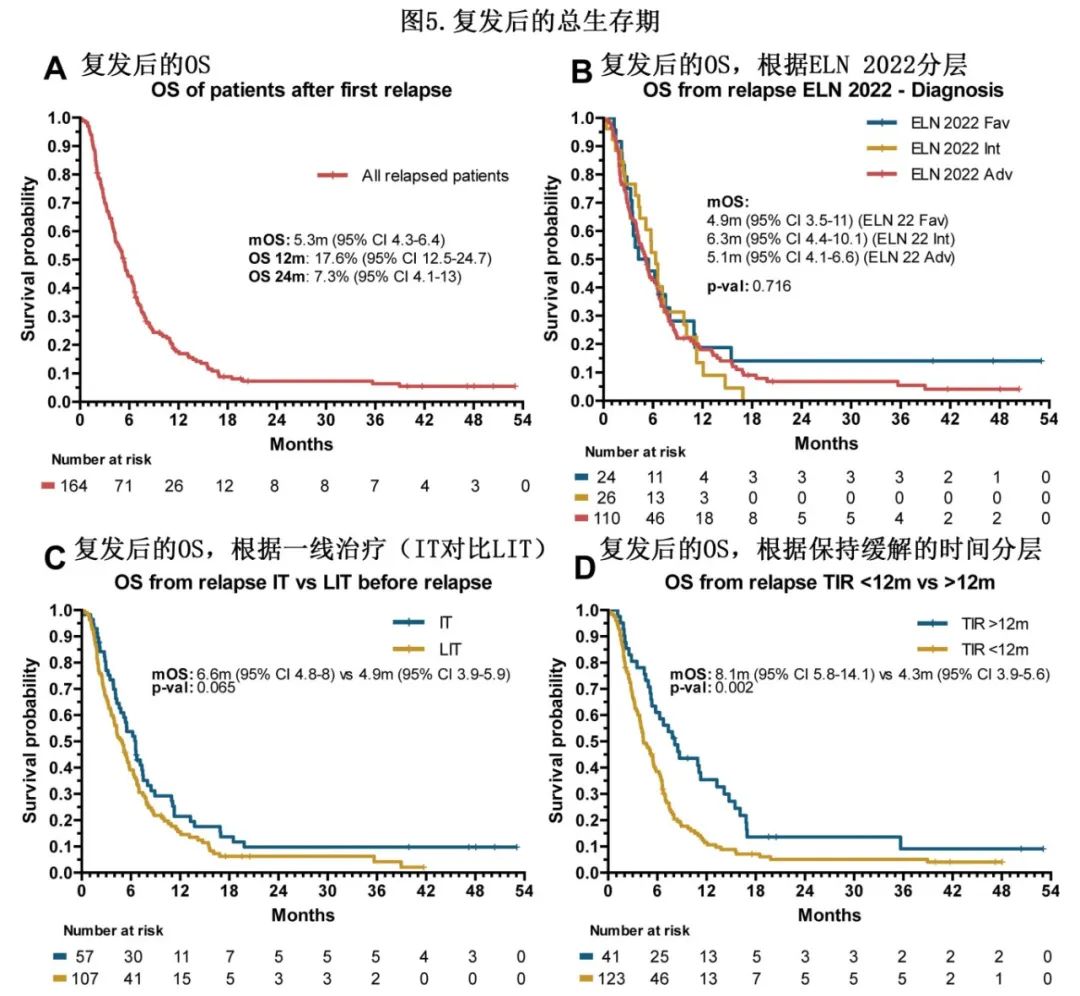
整个队列复发后的中位OS为5.3个月,1年和2年OS分别为18%和7%(图5)。根据复发年龄(<60岁和≥60岁患者分别为6.5和5.1个月[P=0.11])或诊断时接受的治疗类型(IT和LIT治疗患者分别为6.6和4.9个月[P=0.065]),结果OS无差异。从CR到复发时间<12个月的患者的mOS低于>12个月的患者(4.3个月vs 8.1个月[P=0.002])。
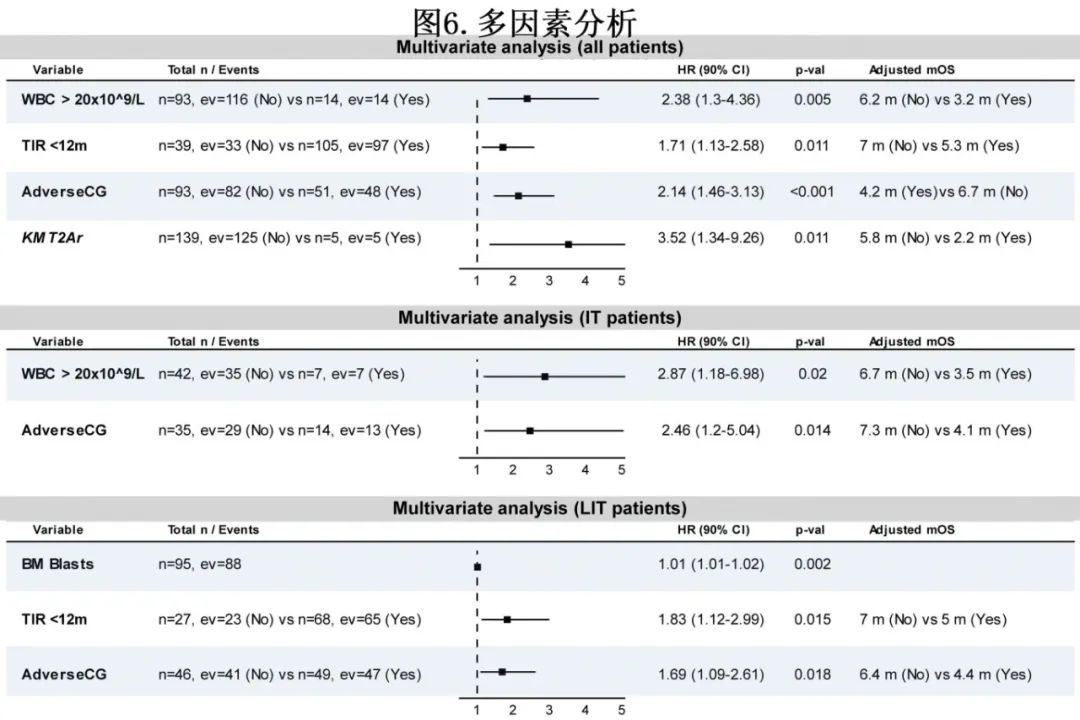
多因素分析显示,复杂核型(危险比[HR] =2.14,P<0.001)、KMT2A重排(HR=3.52,P=0.011)、缓解时间<12个月(HR=1.71,P=0.011)、复发时白细胞计数升高(HR=2.38, P=0.005)是影响OS的独立危险因素。高危细胞遗传学定义为复杂/单染色体核型或5号或7号染色体异常,因为它们在该队列中经常同时出现。图6详细分析了一线接受IT和LIT治疗的患者OS的多因素分析。
总结
作者对大样本rAML患者进行了全面的分析,以确定遗传动力学和生存期预测因素,也是利用诊断和复发的临床和生物学数据分析rAML预测因素的最大回顾性研究之一。共纳入875例接受强化治疗(IT)或低强度治疗(LIT)的新诊断AML患者,其中197例经历随后的rAML。164例患者有详细数据,从CR/CRi到复发的中位时间为6.5个月。164例患者中有35例(21%)在alloSCT后复发。复发时,参与通路信号传导的基因突变趋于消失,而克隆造血相关突变或TP53则趋于持续存在。核型正常的患者在复发时容易出现细胞遗传学异常。接受IT治疗的患者TP53突变发生率(16%)高于接受LIT治疗的患者(1%,P=0.009)。采用挽救性IT或LIT治疗的患者的ORR分别为38%和35%。17例(10%)患者在挽救治疗后接受异基因细胞移植。复发后的中位总生存期(OS)为5.3个月,1年OS率为17.6%。复杂核型(HR=2.14, P<0.001)、KMT2A重排(HR=3.52, P=0.011)、缓解时间<12个月(HR=1.71, P=0.011)、复发时白细胞计数升高(HR=2.38, P=0.005)是影响OS的独立危险因素。
总的来说,无论接受何种挽救治疗,rAML患者的生存率都很低,表明应该努力改善一线AML治疗,以避免疾病复发。作者确定了诊断和复发之间明显的克隆变化,强调在复发时进行细胞遗传学和分子学检测的重要性。开发更有效的一线治疗、改善异基因移植的可及性以及维持策略对于降低复发率都很重要。
参考文献
Bataller A,et al. Outcomes and genetic dynamics of acute myeloid leukemia at first relapse.Haematologica. 2024 May 2. doi: 10.3324/haematol.2024.285057
猜你喜欢
- J Orthop Surg Res:单独垂直钢丝加双侧锚带缝合固定髌骨下极骨折
- 饮食减肥早餐食谱有什么?减肥水果月减30斤靠谱不?
- academic radiology:究竟哪些因素促使了放射科医生诊断错误的发生?
- 这些食物并不能降低胆固醇并且对健康有害
- 《2022 ISPAD临床实践共识指南:儿童和青少年糖尿病患儿运动》解读
- Eur J Heart Fail:Aria 肺血管内装置治疗肺动脉高压的疗效和安全性
- European Child & Adolescent Psychiatry:将青少年心理健康实践护士整合进全科诊所:对儿童和青少年门诊心理健康护理利用的影响
- 提高记忆力的九种食物
- 我国每年猝死人数高达55万 心塞真的能要命!
- HER2阳性乳腺癌新辅助治疗的“新王牌”?SHR-A1811单药pCR率高达63%,挑战传统四药方案
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)