首页 > 医疗资讯/ 正文
本文是由张永昌教授、杨农主任团队联合于2024年在《Med》杂志上发表的题为“First-in-human phase I study of BEBT-109 in previously treated EGFR exon 20 insertion-mutated advanced non-small cell lung cancer”的文章。通讯单位为湖南省肿瘤医院和中南大学湘雅医学院附属肿瘤医院。
该研究是一项针对BEBT-109在EGFR exon 20插入突变阳性的晚期非小细胞肺癌患者中的首次人体I期临床研究。结果显示,BEBT-109在该患者群体中表现出良好的安全性和抗肿瘤活性,有望成为这一特定分子亚型的NSCLC患者的一个治疗选择。
研究背景
肺癌是全球最常见的恶性肿瘤,而非小细胞肺癌(NSCLC)占肺癌的80%以上。EGFR基因突变在NSCLC患者中非常常见,其中约80%为19号外显子缺失或21号外显子点突变,而20号外显子插入突变约占4-12%。
目前,针对19号和21号外显子突变已有多种靶向药物,但20号外显子插入突变对现有EGFR靶向药物具有耐药性。
因此,这部分患者的预后较差,目前仍以化疗作为一线治疗。BEBT-109是一种新型的口服EGFR广谱抑制剂,对EGFR敏感突变和耐药突变都具有很强的抑制活性。
本研究旨在评价BEBT-109在既往接受治疗的EGFR 20号外显子插入突变晚期NSCLC患者中的安全性、耐受性和抗肿瘤活性。
研究方法
研究时间从2020年11月至2022年1月,在中国湖南省肿瘤医院/湘雅医学院附属肿瘤医院进行。
研究纳入标准包括:年龄≥18岁;组织学或细胞学确诊的局部晚期或转移性NSCLC;EGFR突变状态(T790M突变用于剂量爬坡阶段,ex20ins突变用于剂量扩展阶段)通过DNA测序或PCR确认;从一线标准系统性治疗中进展。
排除标准包括:存在症状性脑转移(仅限于剂量爬坡阶段)。
在剂量爬坡阶段,共纳入了11例EGFR T790M突变晚期NSCLC患者,接受BEBT-109 20-180mg/d的口服治疗。
在剂量扩展阶段,共纳入了18例EGFR exon 20插入突变晚期NSCLC患者,接受BEBT-109 120mg QD、180mg QD和120mg BID的口服治疗。
实验技术包括DNA测序用于检测EGFR突变状态,以及影像学用于评估肿瘤活性。
研究设计类型为开放标签、单臂、两阶段临床试验,包括剂量爬坡阶段(评价安全性、耐受性和药代动力学)和剂量扩展阶段(评价安全性和抗肿瘤活性)。
研究结果
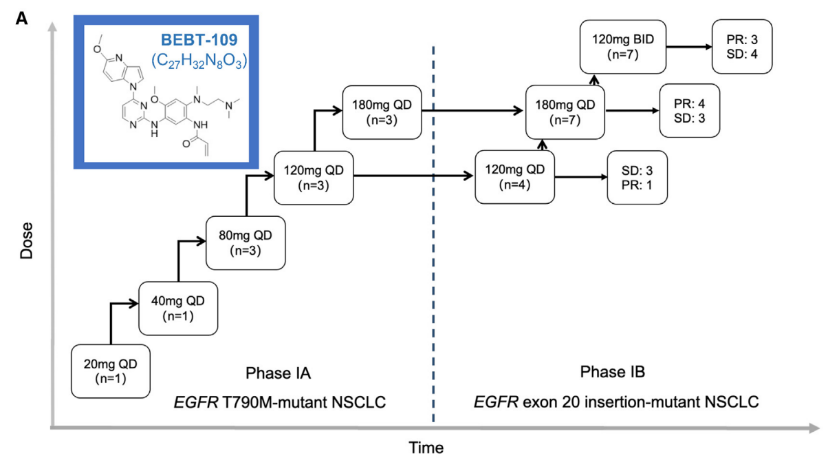
研究的设计方案
在Figure 1A中,左侧部分展示了剂量爬坡阶段中不同剂量组BEBT-109的剂量范围及患者分配情况。
-
剂量爬坡阶段共纳入了11例患者,分别接受了20-180mg/d不同剂量的BEBT-109治疗。
-
而右侧部分展示了剂量扩展阶段中,根据不同剂量亚组BEBT-109治疗的疗效评估结果。
-
结果显示,在剂量扩展阶段,共纳入了18例EGFR exon 20插入突变晚期NSCLC患者,其中,120mg QD组有4例患者,180mg QD组有7例患者,120mg BID组有7例患者。

临床特征
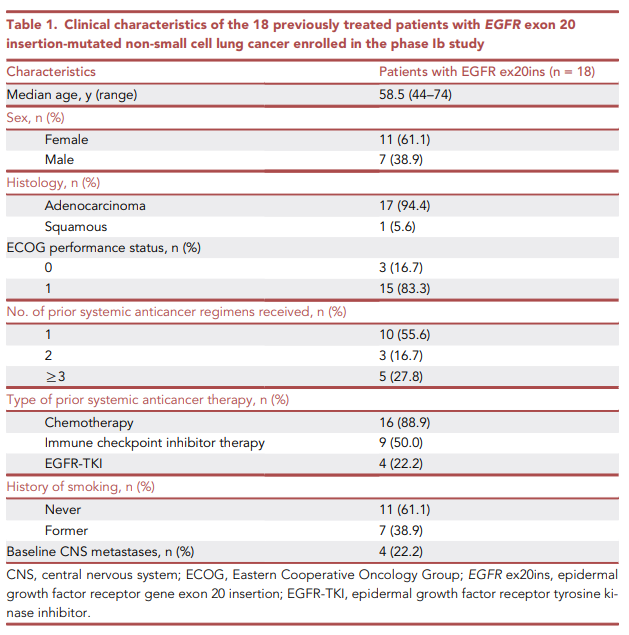
Table 1展示了18例参与BEBT-109治疗的EGFR exon 20插入突变非小细胞肺癌患者的临床特征。
-
该队列的中位年龄为58.5岁,其中女性患者占61.1%,男性患者占38.9%。
-
病理类型以腺癌为主,占94.4%,仅1例为鳞癌。患者体能状态较好,其中ECOG评分为0分的有3人(16.7%),评分为1分的有15人(83.3%)。在既往治疗方面,所有患者均接受过至少一线系统性抗癌治疗,其中16人接受过化疗(88.9%),9人接受过免疫检查点抑制剂治疗(50.0%),4人接受过EGFR-TKIs治疗(22.2%)。
-
此外,11人无吸烟史,7人有吸烟史,4人入组时有脑转移。这些临床特征为后续分析BEBT-109的安全性和疗效提供了基础。
剂量爬坡
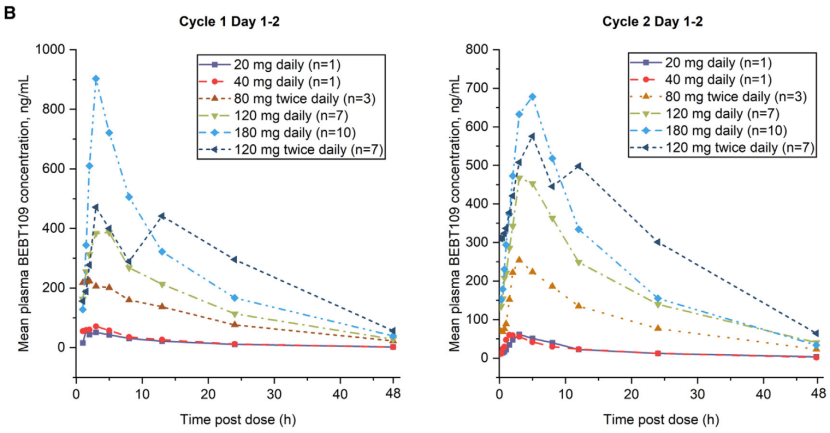
Figure 1B:展示了BEBT-109在不同剂量组的平均血浆浓度。
-
左侧部分展示了第一周期第1-2天BEBT-109在不同剂量组的平均血浆浓度,
-
右侧部分展示了第二周期第1-2天BEBT-109在不同剂量组的平均血浆浓度。
-
结果显示,BEBT-109在20-180mg/d剂量范围内,随着剂量的增加,Cmax和AUC呈剂量比例性增加,表明BEBT-109具有良好的生物利用度。
-
经过28天的连续给药后,BEBT-109的积累指数接近1,提示其药物积累程度较低。

剂量扩展
Table 2汇总了剂量扩展阶段中所有患者(n=18)的治疗相关不良事件(TRAEs)。
-
100%的患者出现了TRAEs,其中38.9%的患者出现了≥3级的TRAEs。
-
最常见的TRAEs包括腹泻(100%,22.2%为3级)、皮疹(66.7%,5.6%为3级)、贫血(61.1%)、血肌酐升高(44.4%,5.6%为3级)和口腔炎(44.4%)。
-
此外,严重TRAEs发生率为22.2%,需要中断治疗的患者占16.7%,需要终止治疗的患者占5.6%,需要减量的患者占5.6%。
总之,BEBT-109治疗显示出较好的安全性和耐受性,其毒性谱与已批准的针对EGFR exon 20插入突变NSCLC治疗的EGFR-TKIs相似。
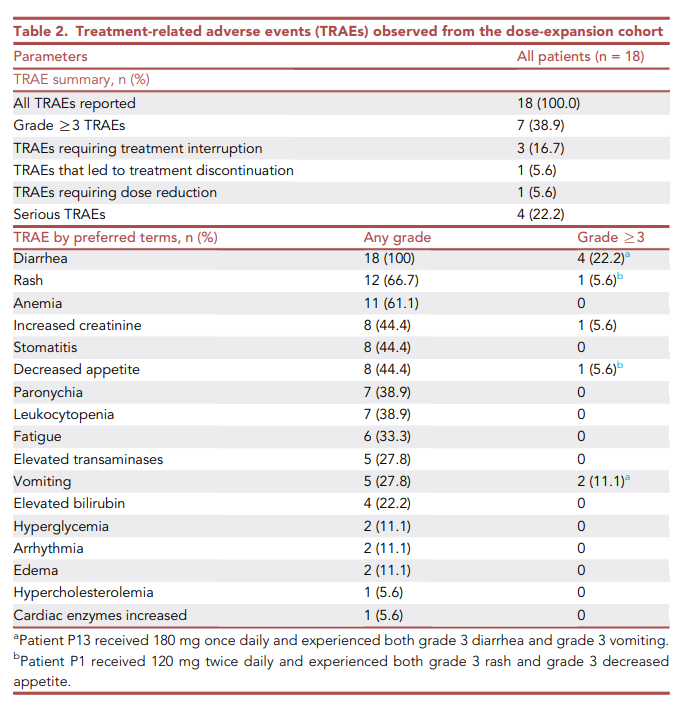
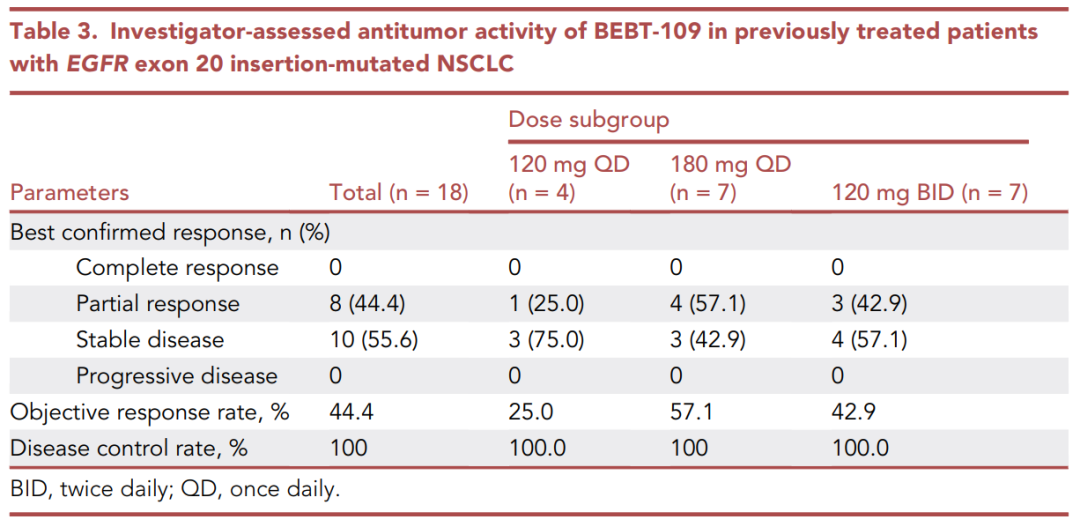
Table 3汇总了剂量扩展阶段中各剂量亚组BEBT-109治疗的疗效评估结果。
-
所有18例患者的疾病控制率(DCR)为100%,其中客观反应率(ORR)为44.4%。在120mg QD组,ORR为25%;
-
在180mg QD组,ORR为57.1%;在120mg BID组,ORR为42.9%。
-
此外,根据突变位点分析,共检测到12种EGFR exon 20插入突变,其中最常见的三种为H773dup(16.7%)、S768_D770dup(16.7%)和A767_V769dup(16.7%)。
-
在常见突变组(n=9)中,ORR为66.7%,而在其他突变组(n=9)中,ORR为22.2%。
-
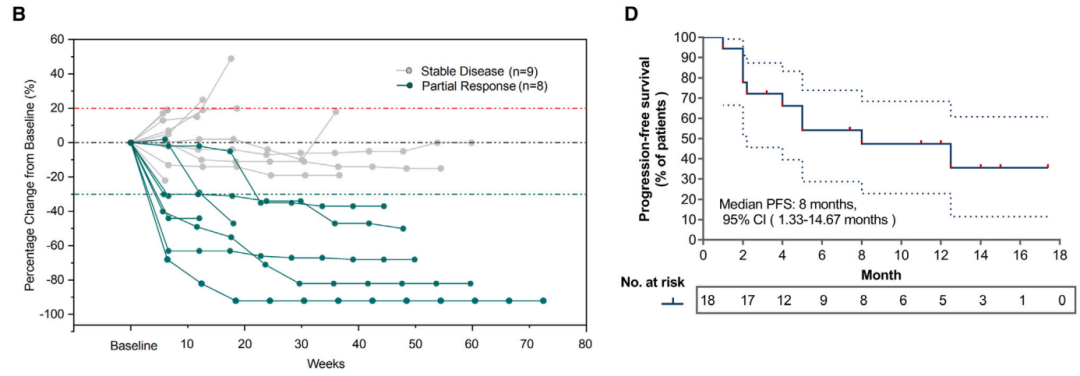
在近环组(n=10)和远环组(n=7)中,ORR分别为40%和42.9%。中位无进展生存期(PFS)为8.0个月。
总之,BEBT-109在既往治疗过的EGFR exon 20插入突变NSCLC患者中显示出良好的抗肿瘤活性和可接受的安全性,可能为这一患者群体提供一种有效的治疗选择。
亚组分析
Figure 2:EGFR exon 20插入突变变异在Ib期研究队列中的分布
-
研究队列中共检测到12种不同的EGFR exon 20插入突变。
-
11种突变位于aC螺旋后的环状结构中,只有1种突变(A763_Y764FQEA)位于aC螺旋区域。
-
在位于aC螺旋后环状结构中的11种突变中,有6种突变(10例患者)位于近环区域(768-770位点),5种突变(7例患者)位于远环区域(773-774位点)。
-
最常见的三种EGFR exon 20插入突变是S768_D770dup(16.7%)、H773dup(16.7%)和A767_V769dup(16.7%)。
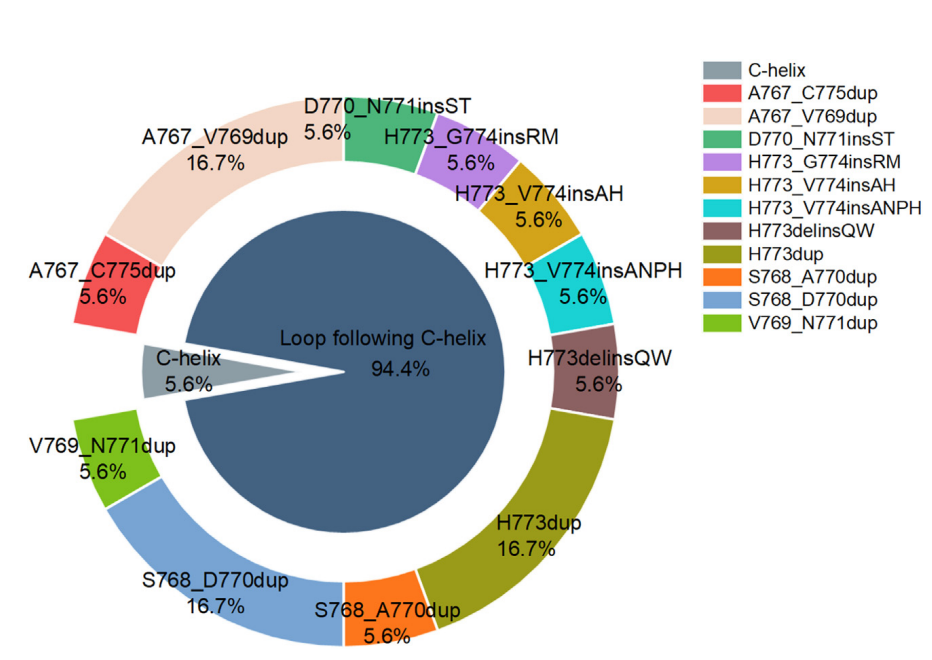

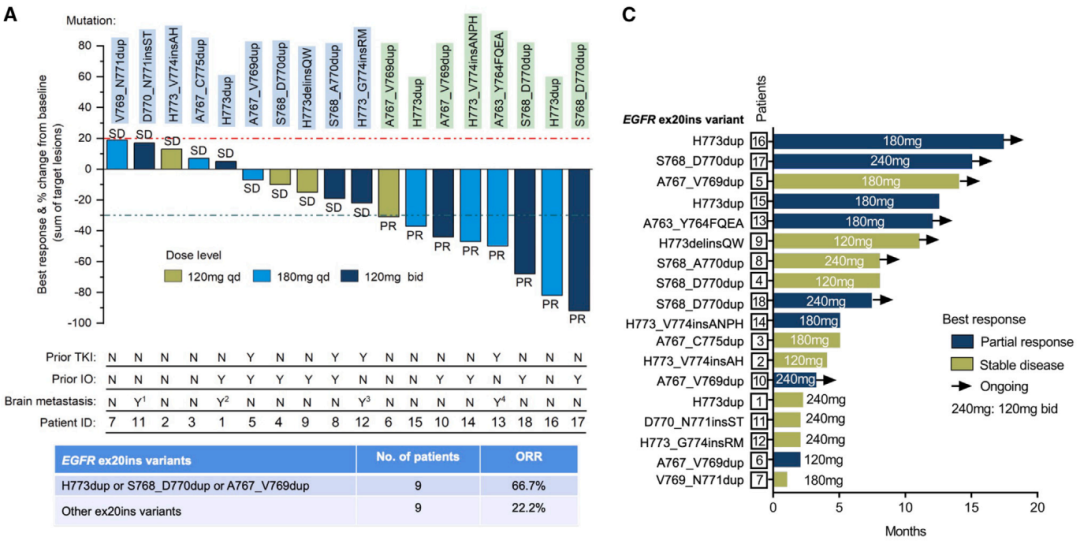
Figure 3:BEBT-109对EGFR exon 20插入突变晚期NSCLC患者的初步抗肿瘤活性
-
所有患者的疾病控制率(DCR)为100%,客观反应率(ORR)为44.4%。
-
在120mg QD组,ORR为25%;在180mg QD组,ORR为57.1%;在120mg BID组,ORR为42.9%。
-
常见突变组(n=9)的ORR为66.7%,其他突变组(n=9)的ORR为22.2%。
-
近环组(n=10)的ORR为40%,远环组(n=7)的ORR为42.9%。
-
14例接受高剂量BEBT-109治疗的患者(180mg QD或120mg BID)中,7例出现部分缓解。
-
4例脑转移患者中,3例达到疾病稳定,1例出现部分缓解,颅内DCR为100%。
-
中位无进展生存期(PFS)为8.0个月。

病例举例
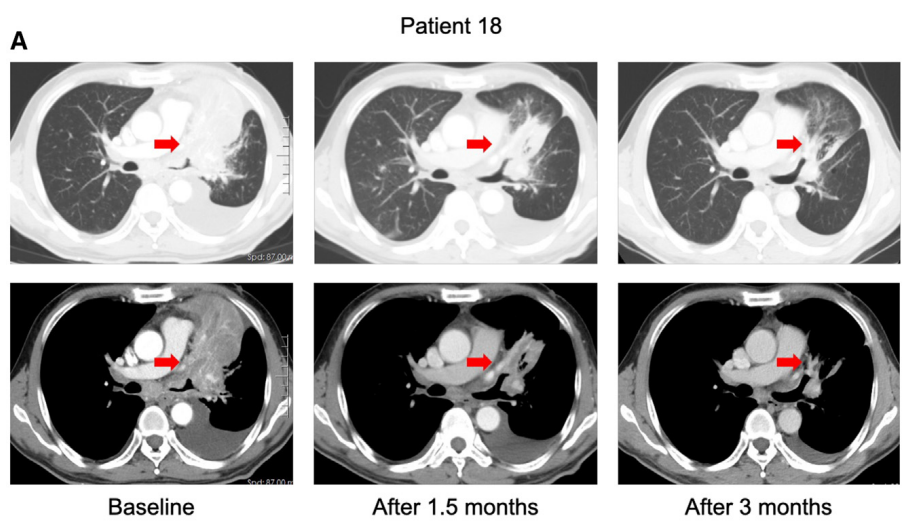
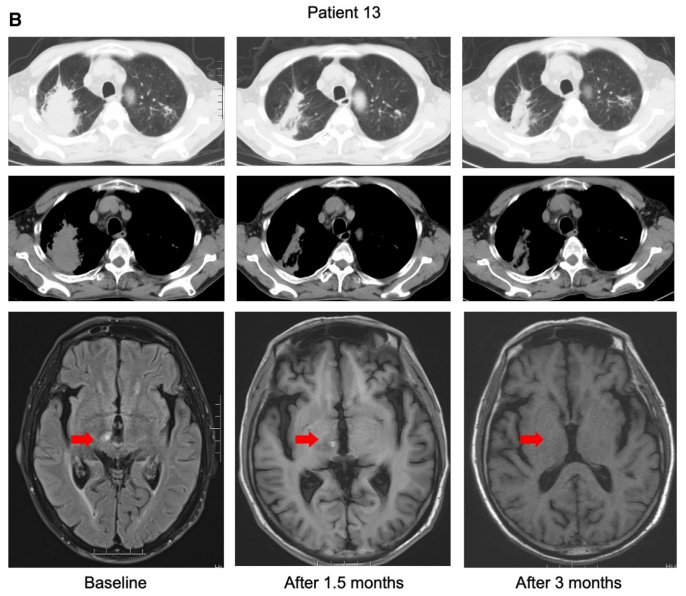
Figure 4提供了两个病例对BEBT-109治疗的反应情况。这两个病例显示,BEBT-109能够有效抑制EGFR exon 20插入突变NSCLC的肿瘤生长,包括脑转移灶。这进一步证实了BEBT-109在该患者群体中具有良好的抗肿瘤活性。
Case 1 (P18):
-
一名患有EGFR exon 20 H773dup突变的晚期肺腺癌患者。
-
接受BEBT-109 120 mg每日两次治疗。
-
在治疗1.5个月后,肺部原发病灶出现显著缩小。
-
在治疗3个月后,肺部原发病灶进一步缩小。
Case 2 (P13):
-
一名患有EGFR exon 20 A763_Y764FQEA突变的晚期肺腺癌患者。
-
曾接受过EGFR-TKI治疗,但病情进展。
-
接受BEBT-109 180 mg每日一次治疗。
-
在治疗1.5个月后,脑转移灶显著缩小。
-
在治疗3个月后,脑转移灶完全消失。

讨论
本研究评估了BEBT-109在既往治疗过的EGFR exon 20插入突变型晚期非小细胞肺癌患者中的安全性和抗肿瘤活性。结果显示,BEBT-109治疗具有良好的安全性和耐受性,常见不良反应包括腹泻、皮疹、贫血等。在18例EGFR exon 20插入突变患者中,BEBT-109治疗的客观缓解率高达44.4%,疾病控制率达到100%,中位无进展生存期为8个月。
与其他针对EGFR exon 20插入突变药物相比,BEBT-109显示出更高的抗肿瘤活性。例如,sunvozertinib、mobocertinib等药物在既往治疗患者中的客观缓解率仅为37.5%左右,而BEBT-109显示出更高的抗肿瘤活性。此外,BEBT-109治疗的疾病控制率和无进展生存期与其他药物相当。
从治疗机制来看,BEBT-109是一种新型泛突变选择性EGFR抑制剂,对EGFR敏感突变和耐药突变具有抑制活性。BEBT-109通过与EGFR激酶结构域中的Cys797位点结合,发挥抗肿瘤作用。与第三代EGFR抑制剂osimertinib相比,BEBT-109对EGFR敏感突变和耐药突变细胞系的抗增殖活性更高。
亚组分析显示,不同剂量组BEBT-109治疗的客观缓解率存在差异。其中,180mg QD组客观缓解率最高,达到57.1%。此外,针对不同突变位点的亚组分析发现,最常见的三种突变(H773dup、S768_D770dup、A767_V769dup)患者BEBT-109治疗的客观缓解率高于其他突变患者。
然而,本研究存在一定的局限性。首先,样本量较小,仅纳入了18例EGFR exon 20插入突变患者,可能导致结果的可信度有限。其次,研究为开放标签、单臂设计,缺乏随机对照,因此结果的可靠性有待进一步验证。此外,未对所有患者进行脑转移评估,可能影响对BEBT-109颅内活性的评价。
为进一步验证BEBT-109在EGFR exon 20插入突变晚期非小细胞肺癌患者中的疗效和安全性,建议开展更大样本量的随机对照研究。同时,探讨BEBT-109治疗耐药的分子机制,以指导治疗策略的优化。此外,未来研究可关注BEBT-109在一线治疗中的应用前景。
综上所述,本研究初步证实了BEBT-109在EGFR exon 20插入突变晚期非小细胞肺癌患者中的安全性和抗肿瘤活性。然而,由于样本量较小和研究设计的局限性,BEBT-109的疗效和安全性仍需进一步验证。未来研究可关注BEBT-109在一线治疗中的应用,以及探索治疗耐药的分子机制,以优化治疗策略,提高患者生存期。
参考文献:
Zeng L et al. First-in-human phase I study of BEBT-109 in previously treated EGFR exon 20 insertion-mutated advanced non-small cell lung cancer. Med. 2024 Mar.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)