首页 > 医疗资讯/ 正文
本文介绍了一名 57 岁男性病例,携带新型MLH1突变MLH1:c.1288G>T,p.(Glu430*),患者有两个同步性结肠肿瘤,最初被认为无法切除,但在接受了帕博利珠单抗新辅助治疗后取得病理完全缓解。基因检测揭示了该新突变存在合子后单碱基嵌合变异。

背 景
与一线化疗相比,免疫治疗为具有高度微卫星不稳定性/错配修复缺陷(MSI-H/dMMR)的转移性结直肠癌带来了获益,可以提高无进展生存期和缓解率。然而,免疫治疗在结直肠癌新辅助治疗中的作用尚不清楚。小规模的研究表明免疫疗法在新辅助治疗中具有一定疗效,但长期结果和获益的具体情况尚不明确。即使对于MSI-H直肠癌,标准治疗仍是手术切除,如果局部晚期肿瘤患者,通常采用新辅助放化疗或化疗。临界可切除结肠癌也缺少标准治疗,通常采用系统性化疗进行“降期”,使肿瘤可切除。因此,有必要明确免疫疗法在MSI-H、局部晚期或临界可切除结直肠癌治疗中的作用,因为在这些肿瘤中,良好的肿瘤反应可能会为患者带来治愈希望(而不是姑息)。
本文介绍了一名既往身体健康的 57 岁男性,是携带MLH1突变的合子后嵌合体,患有两个同步性、最初不可切除的MSI-H/dMMR结肠肿瘤。在接受一个周期帕博利珠单抗治疗后出血停止,两个周期后肿瘤标志物降低,六个周期后肿瘤出现病理完全缓解。本文还描述了MLH1中的一个罕见突变,MLH1:c.1288G>T, p.(Glu430*),这是一种无义突变,预计会在12号外显子中创建终止密码子并导致MLH1功能丧失,这是在该患者中发现的两种MLH1突变之一。
病 例
患者男,57 岁,韩裔,无相关既往病史,于 2021 年 2 月就诊于加拿大西安大略大学普外科,有一年半左下腹不适史。检查显示患者存在小细胞性贫血。CT扫描显示存在两个肿块,一个位于乙状结肠,尺寸为 7.4×6.5 cm,一个位于升结肠,尺寸为 3.5×2.2 cm,右腹部附近有一软组织肿块,尺寸为 3.0×4.0×2.4 cm,可能是受累淋巴结。此外,肝脏中还有一个 0.8×0.7 cm的肿块,倾向于囊肿;左臀部有另一肿块,倾向于表皮包涵体囊肿。令临床医生印象深刻的是两个同步性原发肿瘤且没有转移性疾病。
患者接受了结肠镜检查,发现 25 cm处有一个几乎阻塞了乙状结肠的肿块。由于镜头无法插入并穿过肿块;因此,无法到达升结肠肿块附近进行取样活检。乙状结肠病变活检结果显示为分化良好的腺癌,MLH1和PMS2核表达缺失,无BRAF V600E突变。这表明该肿瘤具有高度微卫星不稳定性/错配修复缺陷(以下称为 MSI-H/dMMR)。
由于即将发生肠梗阻,患者于 2021 年 3 月(诊断后不久)接受了袢式回肠造口术。该手术是基于诊断性腹腔镜检查的结果,术中见肿瘤侵犯前腹壁,从而将这两个肿瘤标记为不可切除。计划使用帕博利珠单抗进行肿瘤内科治疗;然而,在治疗开始之前,患者出现了严重的直肠出血。患者体能状态下降到可接受系统性治疗的临界水平,需要输血。患者入院一周,期间接受了第一剂帕博利珠单抗(由于肿瘤的不可切除性,此时帕博利珠单抗是作为姑息治疗使用)。由于左侧肾灌注减少和左肾积水,他还需要左肾造口管,该手术因肾盂穿孔而变得复杂。出院时,患者的直肠出血已消失。在仅接受第一剂帕博利珠单抗后几天内,患者的血红蛋白水平就可以保持稳定,且患者未接受任何局部治疗或其它治疗。
经过两个周期的帕博利珠单抗治疗后,患者的CA-19已检测不到(治疗前为 41,2021 年 4 月为 25)。CEA仍处于低水平。患者直肠没有再出血。患者经历的主要治疗不良反应是瘙痒,给予羟嗪和局部氢化可的松治疗。经过六个周期的帕博利珠单抗治疗后,患者的肿瘤在查体时不再可触。2021 年 8 月的CT扫描(图1)显示,肿瘤和淋巴结的大小出现间歇性减小,可能是完全缓解,尽管当时尚不能确定。此时,研究人员决定尝试手术切除,患者接受了全结肠切除术、左腹壁和左输尿管整块切除、回直肠吻合术、膀胱镜逆行肾盂造影和双侧膀胱镜检查。2021 年 10 月,进行了输尿管支架置入术,并通过Boari皮瓣重建了左侧输尿管。患者对该手术的耐受性良好,没有出现明显的术后并发症。
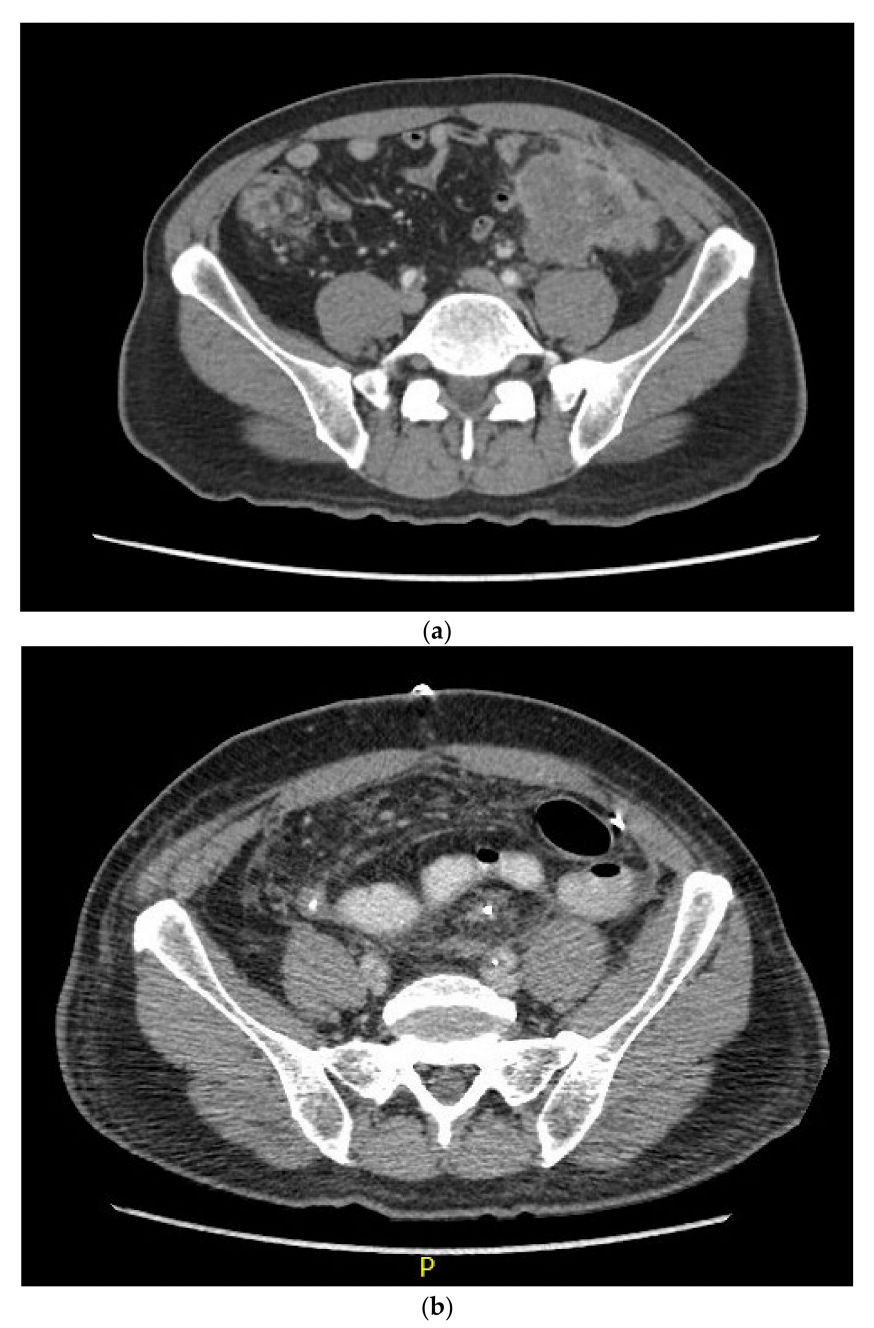
▲图1 CT影像
研究人员通过手术样本的病理学(图2)证实了两个原发肿瘤位置;令人惊讶的是,两个位置都没有残留/存活的肿瘤,因此表明两个肿瘤在帕博利珠单抗新辅助治疗后取得完全的病理缓解。升结肠肿块的病理学显示粘膜下和部分肌内纤维化,与分散的淋巴组织和细胞炎症相关,肿块附近有几个大的反应性淋巴聚集。在结肠周围脂肪中观察到坏死的淋巴结,并且 26 个淋巴结均未发现恶性细胞。乙状结肠肿块的病理学显示纤维化、慢性黄色肉芽肿性炎,偶见空的粘蛋白池。这表明先前的肿瘤部位没有残留/存活的肿瘤细胞。13 个淋巴结均未发现恶性细胞。这代表帕博利珠单抗新辅助治疗为患者带来了病理完全缓解。
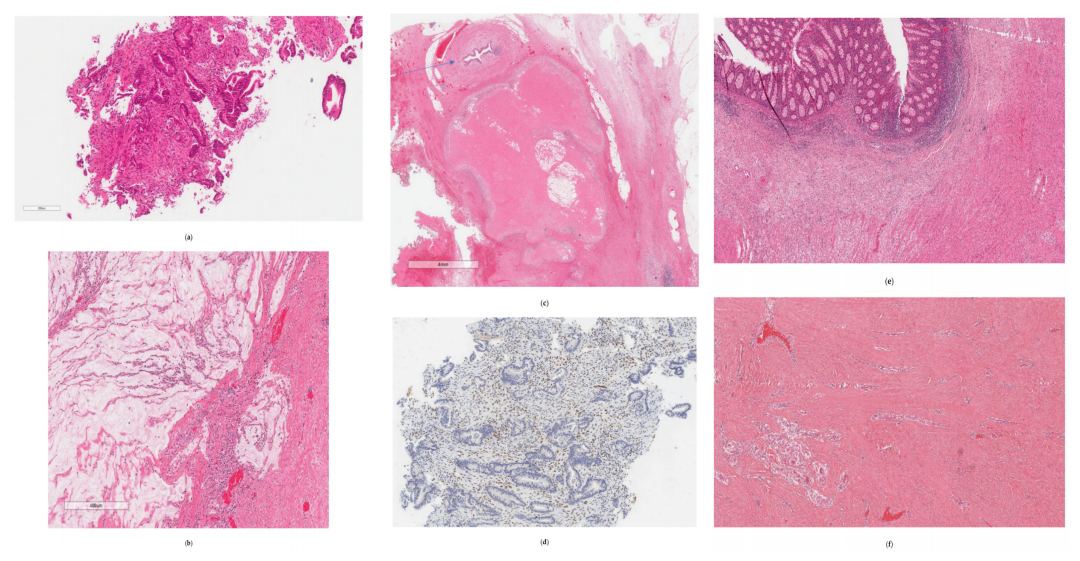
▲图2 病理检查结果
患者自手术后 20 个月内一直保持良好状态,没有疾病复发的证据。患者在辅助治疗中继续使用帕博利珠单抗进行治疗,持续两年,目前仍在进行监测。就在帕博利珠单抗停药之前,患者因胸痛就诊。研究人员初步怀疑是帕博利珠单抗引起的心脏并发症,例如心肌炎和心包炎,并计划征求相关专家意见。然而,在讨论之前,患者因胸痛恶化而被送往急诊科,并被发现患有STEMI(急性ST段抬高型心肌梗死),LAD(左前降支冠状动脉)99% 闭塞。患者接受了血管成形术和支架置入术并取得康复。研究人员认为这一事件与患者的恶性肿瘤无关。
2021 年 2 月对活检肿瘤进行了下一代测序(NGS),结果证明MLH1存在两个突变:第一个是无义突变1288G>T , p.(Glu430*),预计会在12号外显子中产生终止密码子并导致蛋白质过早截断。据研究人员所知,这种突变以前没有在文献中报道过,也没有在任何数据库中列出。此外,还检出了1852_1854delAAG,p.(Lys618del)突变,这是既往在受林奇综合征/遗传性非息肉性结直肠癌(HNPCC)影响的家族中报道过的框内缺失变异。此外,样本中未检测到MLH1启动子甲基化。鉴于患者肿瘤为MSI-H/dMMR(尽管更近端的肿瘤没有组织可用于确认MSI状态)、同步性双原发的存在、未检测到的MLH1启动子甲基化、两个同时存在的MLH1突变以及没有BRAF突变的特点,患者转诊至遗传专家以明确该患者是否罹患林奇综合征/HNPCC。
2021 年 12 月,患者接受了第一次正式的基因检测,包括常规基因检测以及遗传咨询。通过血液样本DNA进行NGS胚系检测,且未在林奇综合征/HNPCC标准检测的 5 个基因中检测到致病性变异。对肿瘤组织进行NGS体系检测,发现两个双等位基因MLH1变异,一个无义突变和一个框内缺失,这一独特的变异情况,可能是患者肿瘤的偶发原因。此时,研究人员认为基因检测结果并不能提示林奇综合征/HNPCC的诊断,因为标准组中的血液中没有发现来自肿瘤的突变。
鉴于至少其中一种突变在既往文献中没有报道过,研究人员对血液样本再次进行了NGS检测,这次专门寻找MLH1:c.1288G>T , p.(Glu430*) 突变,发现其变异丰度为 2.85%。这低于研究人员中心实验室 5% 的正常截断值,表明存在合子后(体细胞)嵌合。为了进一步证实这一诊断,对正常非恶性结肠样本进行了测序,结果显示MLH1:c.1288G>T,p.(Glu430*)变异率为 10.3%。第二个突变1852_1854delAAG , p.(Lys618del)在该测试期间中均未发现。
确诊后,患者的两个女儿接受了基因检测,以寻找罕见的突变。在患者的两个女儿中都没有发现该变异,表明该突变没有从患者遗传给他的后代。
讨 论
据研究人员所知,该病例是首个使用帕博利珠单抗作为新辅助治疗、最初被诊断为不可切除的双原发同步性结肠癌患者,在手术时获得病理完全缓解。
目前免疫治疗在结肠癌中的作用已在转移性患者中得到了确认。最近两项具有里程碑意义的研究巩固了免疫疗法在MSI-H/dMMR肿瘤中的作用。KEYNOTE-177试验证明,在转移性MSI-H/dMMR癌症中,一线帕博利珠单抗优于化疗,事实上,现在帕博利珠单抗已在许多医疗中心常规使用。II 期CHECKMATE-142试验同样证明了一线伊匹木单抗联合纳武利尤单抗在转移性MSI-H/dMMR肿瘤中的疗效。此外,加拿大癌症试验组开展的 II 期CO.26试验证明,与单独使用最佳支持治疗相比,度伐利尤单抗和曲美木单抗(tremelimumab,也称替西木单抗)为晚期难治性结肠癌患者带来了 2.5 个月的生存获益。
在新辅助治疗中,免疫疗法的作用尚不明确。最近有一项研究在新辅助治疗中使用一剂伊匹木单抗和两剂纳武利尤单抗治疗了 40 名早期结肠癌患者,其中一半患者罹患MSI-H肿瘤。在 20 名MSI-H肿瘤患者中,19 名患者出现主要病理缓解—仅残留 10% 或更少的存活肿瘤组织,12 名患者出现病理完全缓解。然而,这些患者都没有携带两个同步性原发结肠肿瘤。
一项 II 期试验评估了围手术期帕博利珠单抗在非转移性MSI-H/dMMR肿瘤(包括结肠癌)中的作用。在 30 名疾病可评估的患者中,有 9 名患者出现完全缓解,但这项研究的最终结果仍需等待。
最近中国的一个病例研究展示了两名结肠癌患者的新辅助免疫治疗;然而,由于缺乏可测量的病灶,无法确定病理反应。最近,一项 II 期试验证明 12 名局部MSI-H/dMMR直肠肿瘤患者获得了完全的临床缓解。然而,所有这些新辅助研究似乎都是在就诊时仅患有一个原发性肿瘤的患者中进行的。
此外,本案例中报告了一个MLH1罕见突变MLH1:c.1288G>T, p.(Glu430*)的合子后嵌合变异,这是一种无义突变,预计会在12号外显子中产生终止密码子。研究人员继续尝试了解该患者病例中两种MLH1突变的重要性,因为由于就诊时的肠梗阻和病理完全缓解,未能了解第二个肿瘤的病理学情况。假设这是双原发的情况,尽管不能完全排除跳跃性转移(虽然从左到右不常见);因此,前者是研究人员在本报告中假设的情况,尽管患者在开始监测之前确实接受了整整两年的帕博利珠单抗治疗。MLH1的合子后嵌合变异很可能使患者倾向于同时发展两个肿瘤。
文献中很少有MLH1合子后嵌合变异的病例。现有文献包括一例MLH1 c.518_519del; p.(Tyr173Trpfs*18)突变病例,患者为一名 31 岁男性,无家族史或遗传史,罹患直肠乙状结肠腺癌,血液检测的突变丰度为 13%。文献中也记录了一个双体细胞突变的病例,其中一个是嵌合变异(与本文病例一致)。基于这个描述了嵌合变异遗传给患者后代的病例,研究人员对本文患者的后代进行了检测,如上所述,结果呈阴性。
本文病例的另一个值得注意的方面是最初的基因检测结果为阴性,这是该变异丰度低于研究人员实验室血液样本 5% 固定截断值的结果,这在研究人员所在的实验室是符合标准的。虽然这种做法可能会降低假阳性,但与任何检测一样,对“阳性”阈值的调整也会对假阳性率产生影响。在嵌合体的情况下,血液中发现的突变水平可能远低于该截断值,如果突变导致局部肿瘤发生或影响生殖器官,则仍然具有临床意义。
总之,本文案例突出了几个发人深省和假设性的情况:
-
与化疗相比,免疫治疗在MSI-H结直肠癌中的反应率更高,这可能表明对于临界可切除性肿瘤,ICI治疗应被视为一线治疗,应在随机临床试验对比标准化疗(放疗)治疗和免疫治疗在MSI-H肿瘤的疗效差异 。
-
MSI-H嵌合体中可能存在多个原发性肿瘤,并与不同的突变相关,并且它们可能都对ICI治疗有反应。
-
认知偏差和避免假阳性率过高而设置的检测策略,可能会导致罕见疾病的漏诊。每当临床进程与初始检测结果不一致时,应重新审视诊断和检查期间做出的假设,并识别检测过程中可能被截止值隐藏的真实阳性结果。
本文展示了一个 57 岁男性MLH1合子后嵌合变异的有趣病例,该男性携带MLH1双重同步突变,其中包括MLH1:c.1288G>T , p.(Glu430*)。该患者患有双原发同步性结肠肿瘤,最初由于侵犯腹壁而被认为无法切除。患者对帕博利珠单抗产生了显著反应,并可接受进行手术。病理学证明帕博利珠单抗新辅助治疗在两个肿瘤部位均产生了病理完全缓解。基因检测揭示了该患者可能存在与Lynch/HNPC样癌症表型相关的合子后嵌合变异。围绕这一现象进行宣讲将有助于提高人们对嵌合体、可能遗传给后代、嵌合体在肿瘤发生中的作用以及基于血液基因检测局限性的认知。未来的研究应正式探讨ICI新辅助疗法在局部晚期结肠癌中的应用。
参考文献:
Preti, B.; Schenkel, L.; Cecchini, M.; Romagnoli, T.; Sanatani, M.S.; French, K.; Colquhoun, P.; Vincent, M.D. Double Duty: Complete Pathologic Response of Two Colonic Primaries with Mosaicism of a Novel MLH1 Mutation to Neoadjuvant Pembrolizumab. Curr. Oncol. 2023, 30, 9039-9048. https://doi.org/10.3390/curroncol30100653

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)