首页 > 医疗资讯/ 正文
临床实验室管理办法和ISO15189:2012均要求实验室应对检验程序的性能进行确认和验证,证实其满足预期用途后方可用于临床检测[1]。CLSI的EP5-A3文件评价周期较长,操作比较复杂,过程繁琐,常用于试剂或仪器制造商确认检测系统精密度。CLSI的EP15-A3操作相对简单,时间较短,适合临床实验室验证检测系统精密度,EP15-A3《用户精密度验证和偏倚评估实验-批准指南》是CLSI在2014年9月发布的,是临床实验室最新的精密度验证和偏倚评估指南[2]。本实验参照CLSI最新发布的EP15-A3文件,对检验科生化室的血清葡萄糖检测系统进行重复性和室内不精密度验证,验证血清葡萄糖的检测系统的精密度是否与厂家试剂说明书声明相符,现将验证过程记录如下。
1 材料与方法
1.1样本 取两瓶RANDOX定值质控品,一瓶是货号HN1530批号1497un效期2024-05-28水平2的质控品,葡萄糖氧化酶法赋值浓度为6.00mmol/L的朗道质控,另一瓶是货号HE1532批号1174UE效期2024-06-28水平3的质控品,葡萄糖氧化酶法赋值浓度为15.6mmol/L的朗道质控,在15~25℃的室温下,准确量取5mL蒸馏水复溶冻干粉,盖上橡皮塞,拧紧瓶盖,避光放置30分钟,轻轻旋转,确保内容物完全溶解,勿剧烈摇晃,避免形成泡沫。按每支450微升分装可分装11支,-20℃冰冻避光保存,每次使用取出一支室温解冻,轻轻震荡混匀后使用。
1.2仪器和试剂 贝克曼AU5800全自动生化分析仪,科华生物的葡萄糖测定试剂盒(批号20230212),氧化酶法,试剂盒自带校准品,校准品批号(20230212)靶值5.55mmol/L.葡萄糖测定试剂盒说明书提供的σR为4%,σWL为5%,试剂盒的线性范围为0.25-27.8mmol/L.
1.3测定流程
1.3.1标本检测前对仪器进行校准且室内质控在控。
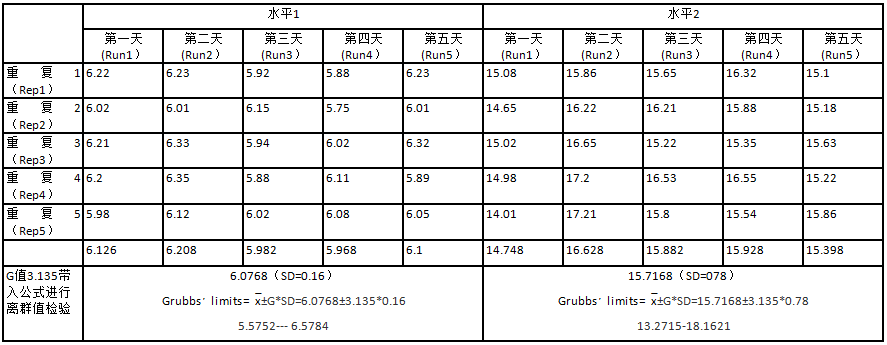
1.3.2按照EP15-A3要求,2个医学决定水平浓度的质控液,采用5×5实验方案 。
1.4离群值检验 利用Grubbs'方法判断离群值,根据数据N(25)和Run(5)查EP15-A3文件附件格拉布斯临界值表G值为3.135,此数据来自格拉布斯(grubbs)临界值表的G 99.50%(25)而来。根据公式Grubbs·limits=x±G×SD确定上下限值,不在此范围的则判断为离群值,25个数据中被剔除的数据不能超过2个[3]。n0=剔除后的数据/Run(5)
1.5数据分析
1.5.1利用SPSS17.0软件统计以下数据
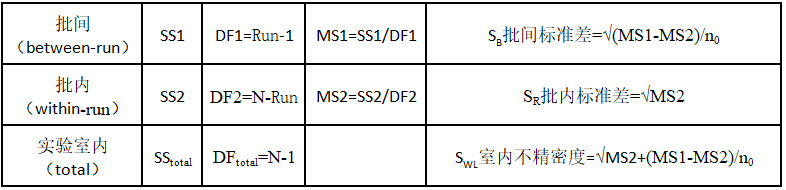
注:如果 MS1<MS2,则设置(MS1-MS2)/n0=0
1.5.2 SR和SWL和制造商给的σR和σWL比较是否通过验证,如未通过验证则计算验证区间UVL的上限值和SR和SWL比较。
1.5.3计算验证区间UVL的上限值
1.5.3.1 计算自由度dfR和dfwL,dfR=N-Run,自由度dfwL:先计算P=σWL/σR值,根据P值和RUN(天数)查表求dfWL
1.5.3.2 UVL的F值,根据相应自由度和水平次数(2个)查表可得F值。
1.5.3.3 计算UVL,UVLR=F*σR=F*%CVR或UVLWL=F*σWL=F*%CVWL与制造商声明精密度(σR和σWL)进行比较。
2 结果
2.1离群值检验:Grubbs'方法水平1的区间在5.5752---6.5784mmol/L,水平2的区间在13.2715---18.1621mmol/L,无离群值。
2.2单因素方差分析:水平1的SR(2.35%)<σR (4.0%) ,SWL (2.68%)<σWL(5%),水平1的批内和实验室内精密度验证通过;水平2的SR(3.24%)<σR (4.0%) ,水平2的批内精密度验证通过,SWL (5.30%)>σWL(5%),建议和验证区间UVLWL的上限值比较。
2.3 P值=σWL/σR=5%/4%=1.25,根据P值和RUN(5)查表求dfWL,自由度为14。自由度为14结合2个水平次查表求F值为1.37,UVLWL=F*%CVWL=1.37*5%=6.85%,SWL (5.30%)<uvlWL(6.85%),水平2的实验室内精密度通过验证。实验室测定血清葡萄糖的检测系统的不精密度达到厂家试剂说明书声明要求,与厂家声明的一致。
3 讨论
精密度验证的样品可以是质控品或新鲜冷冻血清,至少需要两个不同浓度,样品的浓度应尽可能与厂商精密度声明所用的浓度接近,便于比较;若有可能,最好能够选择参考区间两端或医学决定水平处的浓度进行实验,以确定对临床有影响的关键浓度点的性能。精密度验证实验均可采用《WST 492-2016临床检验定量测定项目精密度与正确度性能验证》CLSI EP15-A2或EP15-A3方案:WST492-2016是EP15-A2方案的中国化[4],即常规质控在控的条件下,对精密度评价样品每天只做1批,每批重复测定3次,连续测定5天,共获得15个数据,简称3x5实验方案。EP15-A3方案实验要求同EP15-A2,只是每批重复测量5次,连续5天,共获得25个数据,简称5x5实验方案。计算重复性CV和室内CV,并与厂商声明的性能和质量指标进行比较。CV小于或等于厂商声明,精密度性能达到验证。当CV大于厂商声明时,需通过统计学处理比较实验得出的CV与厂商声明有无差异,若没有差异,厂商的性能仍达到验证。EP15系列指南文件先后采用3✕3/3✕5(EP15-A)、3✕5(EP15-A2)、5✕5(EP15-A3)方案,不断变更,标准差以及方差是统计学中描述数据离散程度的有效指标,3个有效数据是计算标准差和方差的最小数量,因此在排除离群值后,EP15方案考虑使用者的便捷性和成本需求,采用重复3次和检测3天作为方案要求,因为数据越少,数据离散程度就越不稳定,一般来说,自由度越小(相当于重复检测次数),得到的抽样标准差值具有的可信性较差,即标准差的可信区间很大,过少的数据也会影响计算结果的稳定[5]如果这个时候都可以满足厂商标注的要求,大概率检测系统是符合要求的,所以可能在权衡利弊后,目前在EP15-A3中采用5✕5方案。
参考文献
[1]康凤凤,王治国.ISO15189:2012与临床检验定量检测方法确认和性能验证[J].临床检验杂志,2013(12):881-884页.
[2]徐建华,刘冬冬,徐宁,等.CLSI EP15-A3在临床生化精密度验证中的应用[J].临床检验杂志,2016,34(3):215-218.
[3]郭绪晓,柏淑美,凌欣,等.能力验证/室间质量评价标本在电化学发光检验程序正确度验证中的应用[J].检验医学,2019,34(9):851-854.
[4]孙龙乔子,黄利思,丘元福,等.Lp-PLA2酶法测定试剂盒的临床应用评价[J].标记免疫分析与临床,2023,30(5):846-850.
[5]冯仁丰. 再说说精密度[J].检验医学,2014(8):787-793.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)