首页 > 医疗资讯/ 正文
骨关节炎(OA)是一种以关节软骨渐进性退化为特征的慢性关节疾病。在疾病修复药物的开发中,有效传递给软骨细胞是一个挑战。关节的独特结构促进了药物通过滑膜液的快速清除,而密集且无血管的软骨细胞外基质(ECM)限制了药物的渗透。
2024年2月21日,国家纳米科学中心聂广军团队与北京大学第三医院余家阔团队合作在Science Translational Medicine在线发表题为“Chondrocyte membrane–coated nanoparticles promote drug retention and halt cartilage damage in rat and canine osteoarthritis”的研究论文,该研究展示了以软骨细胞膜(CM)包被的聚乳酸-聚乙二醇酸(PLGA)纳米颗粒与未包被的纳米颗粒相比,在体外更易被大鼠软骨细胞优先摄取。CM-NPs的内部化主要通过E-钙粘蛋白介导、网格蛋白覆盖的细胞吞噬作用和微囊泡内吞作用来介导。这些CM-NPs在大鼠膝关节的软骨ECM上粘附,在体内深入渗透软骨基质,并具有超过34天的驻留时间。
模拟滑膜液清除研究表明,载有Wnt通路抑制剂adavivint(CM-NPs-Ada)的CM-NPs延迟了大鼠和人类软骨细胞及软骨外植体在炎症条件下的分解代谢。在大鼠OA的手术模型中,载药的CM-NPs有效恢复了步态,减轻了关节周围骨重塑,并提供了对软骨退变的保护作用。在前交叉韧带切断的犬模型中,CM-NPs-Ada也减轻了OA的进展。这些结果证明了使用软骨细胞膜包被的纳米颗粒来改善抗OA药物的药代动力学和疗效的可行性。

骨关节炎(OA)是一种高度普遍的退行性关节疾病,全球有超过5亿人受其影响,造成了巨大的社会和经济负担。OA的特征是局部进行性关节软骨退化、关节炎症和病理性骨下重建,导致慢性疼痛和最终关节功能失败。对于OA患者的症状,有各种干预方法可供选择;然而,目前尚无可用的改变疾病进程的治疗方法。一些生物制剂和小分子药物,如促进生长因子、基质降解酶抑制剂和抗炎分子,在临床前研究中显示出抑制软骨退化的潜力。然而,不幸的是,这些药物候选物未能从临床试验进展到临床实践,因为它们对患者的益处有限。
在OA治疗的药物治疗中,一个主要挑战是维持足够的有效药物浓度,以诱导所需的生物学反应。由于关节软骨缺乏血管,全身药物给药导致软骨的分布不足。直接关节内注射是增加关节生物利用度、减少全身不良反应的合理方法;然而,即使是局部给药仍然不足够。药物通过滑膜毛细血管和淋巴引流迅速从关节腔中清除,关节中的停留时间短至1到4小时。残留在关节内的极少量药物被关节软骨外基质所排除。
关节软骨外基质由软骨细胞合成,由胶原纤维、聚糖蛋白和其他几十种细胞外大分子组成。因此,ECM不仅保护着软骨细胞,而且对于治疗分子从滑膜液渗透并进一步被软骨细胞内化构成了重要的空间障碍。结合临床医生需要最大程度地减少由于反复关节内注射而导致的感染风险,滑膜液中药物半衰期短和不足够扩散到软骨的两个重要生物学屏障,限制了连续治疗,从而影响了长期效果。
因此,治疗OA的理想药物输送平台能够在被清除之前足够渗透软骨并结合软骨内的部位,将屏障转化为持续的组织内递送药物的药库。软骨细胞合成并维持ECM以抵抗物理变形,并表达许多细胞表面标志物与周围ECM相互作用。在软骨细胞和基质之间的相互作用中,膜表面的粘附受体在介导细胞与ECM之间的相互作用中起着重要作用。例如,II型胶原(COLII)具有α1β1、α2β1和α10β1整合素的结合位点,而纤维连接蛋白结合整合素包括α3β1和αVβ1。软骨细胞膜(CM)CD44负责在ECM中特异性结合透明质酸。
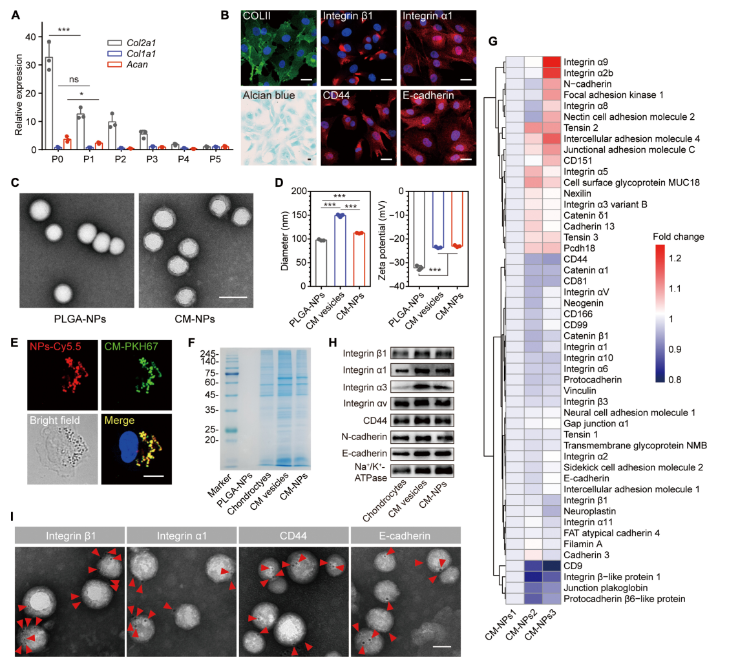
CM-NPs保留了大鼠原代软骨细胞膜的蛋白谱(图片源自Science Translational Medicine )
通过将亲和配体连接到药物载体的表面,可以实现活性纳米颗粒靶向,从而通过配体-受体相互作用靶向软骨细胞或ECM。功能化的聚合物纳米颗粒与II型胶原抗体和胶原结合肽结合后,可以特异性地结合到软骨并将治疗药物传递到软骨细胞中。随着OA中软骨损伤的增加,软骨成分(如蛋白多糖和胶原)逐渐丧失,使得 passi目标的结合能力和单一配体修饰的活性靶向策略受到限制。为了克服现有策略在靶向软骨内个别组分方面的局限性,混合纳米颗粒融合多种亲和配体可能提供了比单一配体修饰的靶向策略更优越的结合能力。
软骨细胞-基质相互作用的独特性质启发作者直接利用天然衍生的CM涂层作为赋予软骨药物输送系统增强特异性和结合能力的手段。在此,作者设计了工程化的CM修饰的聚乳酸-聚乙二醇酸(PLGA)纳米颗粒(CM-NPs),并研究了它们作为OA管理的药物储库的用途。通过在PLGA核心表面显示软骨细胞质膜,CM-NPs模拟了软骨细胞,并结合到软骨ECM上,以实现药物的有效保留和渗透,以达到同种型软骨细胞并最终引发持续的软骨保护。
北京大学第三医院与国家纳米科学中心联合培养博士生邓荣辉、国家纳米科学中心赵瑞芳为该文章的共同第一作者。赵瑞芳副研究员、聂广军研究员和余家阔教授为文章的共同通讯作者。上述研究工作得到了国家自然科学基金基础科学中心项目,北京市自然科学基金项目,中国科学院战略性先导科技专项等项目支持。
原文链接:
https://www.science.org/doi/10.1126/scitranslmed.adh9751
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)