首页 > 医疗资讯/ 正文
免疫球蛋白E (IgE)过去认为主要参与过敏反应和抗寄生虫感染,近年来,越来越多的研究表明IgE与心肺血管疾病的发生发展相关。有研究显示,过敏性哮喘可以加重高脂诱导的动脉粥样硬化的发生。然而,具体分子机制仍不明确,并且,正常饮食条件下,过敏性哮喘是否也增加动脉粥样硬化患病风险也需明确。
2024年1月18日,中国医学科学院基础医学研究所赵红梅副研究员和王婧研究员与北京协和医院刘暴教授以及北京医院安琦教授在Arteriosclerosis, Thrombosis, and Vascular Biology杂志在线发表题为“Exosomes From IgE-Stimulated Mast Cells Aggravate Asthma-Mediated Atherosclerosis Through circRNA CDR1as-Mediated Endothelial Cell Dysfunction in Mice”的研究论文,揭示了经IgE刺激后的肥大细胞通过“外泌体-环RNA CDR1as-内皮细胞”途径介导哮喘加重动脉粥样硬化的机制,为哮喘合并动脉粥样硬化人群的干预提供了新思路。

首先,研究者采用卵清蛋白(Ovalbumin, OVA)构建了正常饮食的ApoE-/-小鼠哮喘模型,发现敲除IgE受体FcεR1可有效减轻由哮喘引发的动脉粥样硬化的加剧及相关病变处的炎症反应。具体表现为动脉粥样硬化斑块减小,血管浸润的炎症细胞包括巨噬细胞、MHC-II+细胞、CD3+ T细胞和肥大细胞数量显著下降。此结果提示:在正常饮食喂养的小鼠中,过敏性哮喘通过IgE-FcɛR1介导的炎症作用加重了动脉粥样硬化。

接下来,研究人员通过应用IgE单克隆抗体奥马珠单抗,探究阻断IgE能否有效减轻哮喘诱发的动脉粥样硬化。结果显示,奥马珠单抗能有效降低小鼠血清IgE水平,显著缓解脂质沉积和炎性细胞的浸润。因此,阻断IgE能够有效减轻哮喘介导的动脉粥样硬化。

鉴于炎症和肥大细胞在哮喘发病中的重要作用,研究者探究了传统抗炎药物地塞米松和肥大细胞稳定剂Cromolyn对哮喘介导的动脉粥样硬化的干预效果。结果显示,相较于OVA哮喘模型小鼠,地塞米松和Cromolyn治疗显著降低了主动脉根部及主动脉弓部位的动脉粥样硬化病变面积和炎症细胞数量(包括肥大细胞、巨噬细胞、MHC-II+细胞和CD3+ T细胞);但与未造模的小鼠相比,地塞米松和Cromolyn的治疗在动脉粥样硬化病变面积和炎症细胞数量上也存在统计学差异,提示地塞米松的抗炎作用和Cromolyn对肥大细胞的稳定作用只能部分缓解哮喘诱发的动脉粥样硬化,这表明可能存在着其他机制参与哮喘引发的动脉粥样硬化过程。

哮喘诱发动脉粥样硬化过程中,炎性细胞在血管的浸润是主要病理特征,而敲除FcεR1可以显著减轻炎性细胞浸润,本研究发现肥大细胞作为IgE的主要靶细胞及分泌性细胞,能够持续释放外泌体。并且进一步的机制研究显示,来自IgE激活的肥大细胞的外泌体通过circRNA CDR1as介导的内皮细胞功能障碍加剧了动脉粥样硬化。
在体外实验中,肥大细胞系LAD2在IgE刺激24小时后,由其释放的外泌体中的circRNA CDR1as表达上调,而这一现象不受肥大细胞稳定剂Cromolyn的影响,并且经过PKH67标记的肥大细胞来源的外泌体可以进入内皮细胞中。这表明,外泌体可能作为一种细胞间的通讯因子,在哮喘介导的动脉粥样硬化中发挥重要作用。

接下来研究人员在体内实验中探索外泌体是否能将circRNA CDR1as传递给内皮细胞,发现通过小鼠尾静脉注射的PKH67标记的肥大细胞外泌体能够被血管内皮细胞吸收,并且在内皮细胞中观察到CDR1as的显著增加,且外泌体的富集效应在干预后呈时间梯度降低。
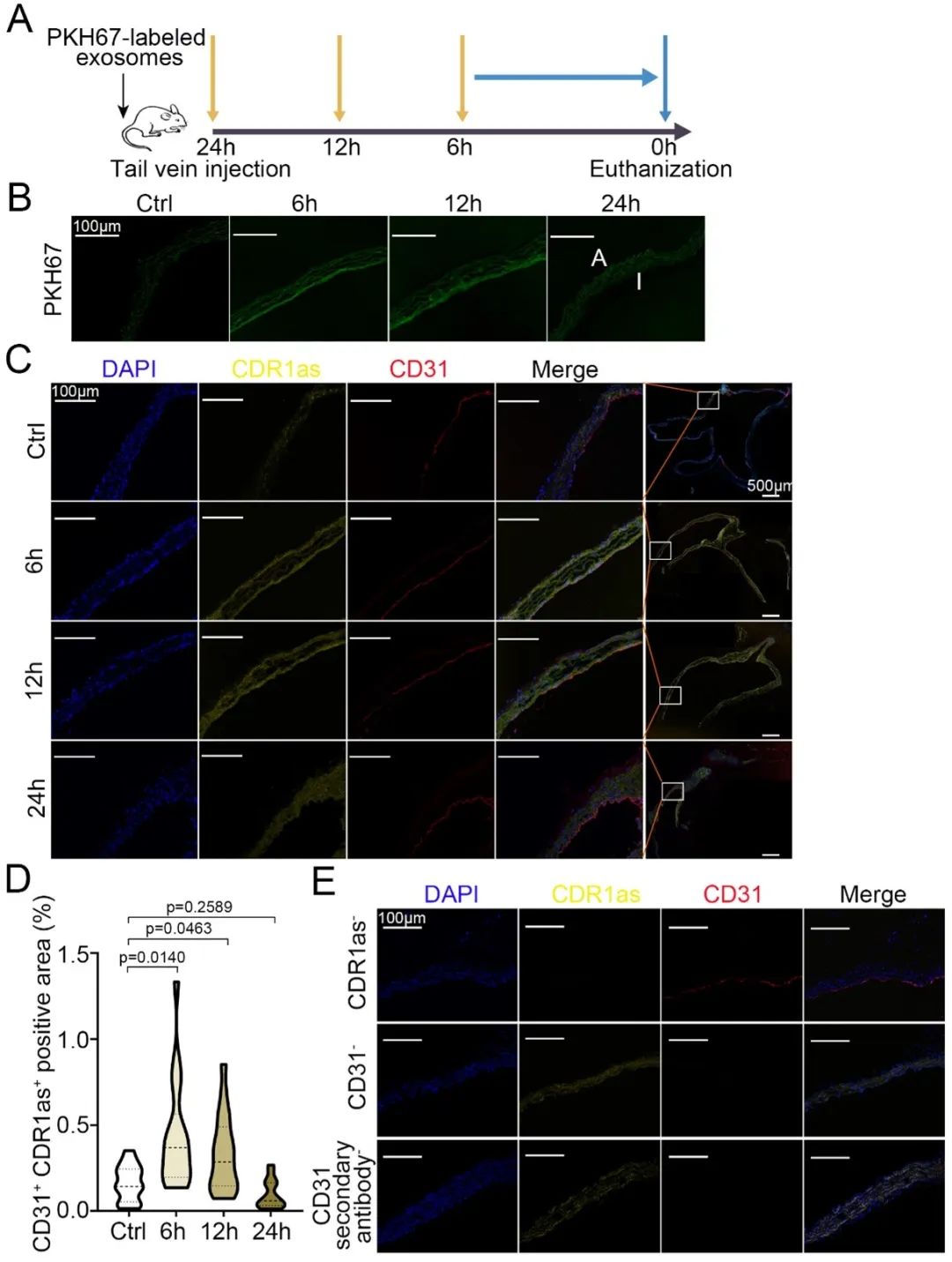
为进一步探究CDR1as在体内的功能,研究人员构建了CDR1as敲低小鼠的哮喘模型,发现CDR1as缺陷能够改善内皮细胞粘附功能,从而缓解了哮喘诱导的动脉粥样硬化的发生发展。

最后,研究者进行了CDR1as与临床动脉粥样硬化指标的相关性分析,以评估CDR1as与动脉粥样硬化疾病的相关性。探讨了患有动脉粥样硬化、过敏合并动脉粥样硬化以及健康个体的人类血浆中CDR1as的表达水平,发现在排除年龄、性别、血脂水平、糖尿病、高血压、吸烟状态等因素后,过敏合并动脉粥样硬化患者血浆中CDR1as水平较单纯动脉粥样硬化患者明显增加。另外发现血浆中CDR1as水平与血脂指标包括甘油三酯、高密度脂蛋白和低密度脂蛋白之间没有相关性,这意味着CDR1as不参与调节血脂,而血管内皮细胞黏附功能障碍和炎症可能是CDR1as发挥作用主要途径。以上结果表明,CDR1as有望作为动脉粥样硬化,尤其是哮喘合并动脉粥样硬化的一个新型生物标志物和干预靶点。

综上所述,研究人员发现哮喘介导动脉粥样硬化的新的机理和靶点,发现使用IgE抗体(奥马珠单抗)或敲除FcεR1来阻断IgE-FcεR1信号在正常饮食条件下能有效缓解哮喘引起的动脉粥样硬化。机制方面,发现IgE可刺激肥大细胞释放的外泌体,通过递送包裹的环RNA CDR1as到血管内皮细胞,激活FUS-phos-p65-VCAM1/ICAM1信号轴,通过增强内皮细胞的粘附能力和炎症浸润水平,从而促进动脉粥样硬化的进展。这一发现为理解哮喘与动脉粥样硬化之间复杂的相互作用提供了新的理论支持。

近年来,该团队对IgE-FcεR1信号在心肺血管疾病中的功能及作用机制展开了深入研究,揭示了多种心肺血管疾病状态下IgE水平升高与疾病发生发展的关系(Circulation. 2021; 143(10):1014-1030; Theranostics. 2021; 11(15):7600-7615; Cardiovasc Res. 2022; 118(14):2985-2999等)。此研究揭示了IgE-FcεR1信号在哮喘介导的动脉粥样硬化发生发展中的重要作用,解析了哮喘引发动脉粥样硬化的病理新机制,为哮喘合并动脉粥样硬化患者干预提供新的思路。
中国医学科学院基础医学研究所杨红琴、陈俊冶、刘思杨为本文共同第一作者,基础医学研究所赵红梅副研究员和王婧研究员、北京协和医院刘暴教授、北京医院安琦教授为共同通讯作者。该研究获得国家自然科学基金(82270403)、国家重点研发计划(2019YFA0801804和2019YFA0801703)、中国医学科学院医学与健康科技创新工程(2021-I2M-1-016)等资助。
原文链接:
https://doi.org/10.1161/ATVBAHA.123.319756
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)