首页 > 医疗资讯/ 正文
摘要
目的 阻塞性睡眠呼吸暂停(OSA)患者存在日间过度思睡(EDS)、失眠等症状不同的亚型。目前尚不清楚蛋白质组学在OSA伴EDS和伴失眠的患者之间是否存在差异。因此,我们检测了OSA不同临床亚型患者的血清蛋白质组,旨在确定潜在的生物标志物,为OSA不同临床亚型的划分提供依据,同时探讨不同亚型的分子生物学机制。方法 本研究纳入空军军医大学第二附属医院的6例OSA患者,其中3例为OSA伴EDS患者,3例为OSA伴失眠患者,均进行整夜多导睡眠监测(PSG)及睡眠量表评估,并在PSG次日晨采集血液,应用蛋白质非标记定量方法(Label-free)筛选差异表达蛋白并进行生物信息学分析。结果 我们确定了34个蛋白的一个子集,这些蛋白在OSA伴EDS、伴失眠患者之间表达不同。相对于OSA伴失眠组,OSA伴EDS组血清蛋白表达上调的有20个,表达下调的有14个。生物信息学分析发现,差异蛋白的主要功能集中于DNA损伤、活性氧清除、免疫调节和炎症反应,主要参与细胞内转运、分泌和囊泡转运等生物过程。差异表达蛋白主要定位在细胞质,或为分泌蛋白。可能在OSA不同临床亚型中发挥重要作用的途径为APRT-AK1相互作用。结论 在本研究中,我们确定了两种亚型OSA患者的34种差异表达蛋白,如在OSA伴EDS患者血清中显著上调的DDI2、PRDX6蛋白等,可识别OSA不同的临床亚型。此外,可能在OSA不同亚型中发挥重要作用的途径为APRT-AK1相互作用。
阻塞性睡眠呼吸暂停(obstructive sleep apnoea,OSA)是常见的睡眠呼吸障碍之一,OSA导致患者生活质量降低、工作能力受损和意外风险增加,并与高血压、2型糖尿病、房颤、心力衰竭、卒中和死亡等的发生率增加有关,影响全球近10亿人的健康,OSA患病率随年龄增长而增加。OSA常见的临床症状有打鼾、睡眠中反复憋醒、头昏等,日间过度思睡(excessive daytime sleepiness,EDS)是OSA患者就诊的主要原因,失眠也是OSA的常见伴随症状。国内外OSA诊治指南将呼吸暂停低通气指数(apnea-hypopnea index,AHI)作为OSA严重程度评估及疗效评价的标准,并推荐将持续气道正压通气(continuous positive airway pressure,CPAP)作为一线治疗手段,当CPAP不耐受或治疗失败时才考虑其他治疗手段。因此,目前OSA的诊疗体现了一种“一刀切”的模式。
然而,OSA是一种异质性疾病,不同OSA患者具有不同的风险因素、临床表现和结局预后。目前国内外已有不少研究探索了OSA 患者中可能存在的临床亚型,并发现不同临床亚型患者在生活质量、治疗获益以及心血管病长期风险等方面存在差异。此外,CPAP治疗能够显著降低患者的AHI指数,但只能改善部分患者的症状,仍有相当比例的患者存在残留EDS及失眠症状的加重,失眠的OSA患者对CPAP治疗的接受度和依从性也并不理想,因此有必要对OSA进行不同临床亚型的划分。既往研究中OSA的亚型划分包括基于多导睡眠监测(polysomnography,PSG)参数划分为快速眼动睡眠(rapid eye movement,REM)期OSA、体位性OSA的;基于共病划分的;或是基于症状划分为“过度嗜睡”和“睡眠障碍”等。PSG的监测过程及依赖于专业技术人员判图耗时耗力,共病涉及的疾病种类多且繁杂,基于症状的亚型划分方法虽简单易行,但依据的是患者的主观报告。将体液尤其是血液指标作为OSA临床亚型划分依据的现有研究较少,如能将临床症状与血液生物标志物指标结合起来,对OSA患者进行亚型划分,将克服各自的不足,大大提高亚型划分的说服力。
目前,OSA表现为不同症状亚型的生物标志物和分子机制仍不明确,蛋白质组学能够准确地检测出生物样品中数以万计的蛋白质及其分子修饰,最近有部分研究在OSA与健康患者间进行了差异蛋白质组学分析,从中筛选出差异表达的蛋白质,能够将OSA与健康患者区分开并利用组学分析对OSA进行了发病机制的解释,但目前尚无在OSA不同亚型中进行蛋白组学比较的研究。
为此,本研究拟检测OSA伴EDS和OSA伴失眠受试者的血清蛋白质组学,分析差异表达蛋白谱,并进行生物信息学分析,为寻找OSA症状亚型相关的生物标志物和探讨发病机制提供参考。
1 资料与方法
1.1 研究对象 连续纳入2022年1月-4月就诊于空军军医大学第二附属医院神经内科睡眠中心的患者,确诊为OSA的患者6例。6例研究对象均为男性,年龄在25~45岁之间。分为两组:OSA伴EDS组和OSA伴失眠组。对同意参加研究的患者及健康受试者进行关于个人史的详细访谈、相关疾病和合并症的一般体格检查及血液样品采集。对OSA和失眠患者进行了整夜PSG监测,所有参与者均填写了睡眠问卷,包括STOP-BANG、爱泼沃斯嗜睡量表(Epworth Sleepiness Score,ESS)、失眠严重程度指数(Insomnia Severity Index,ISI)量表。纳入受试者的基本特征见表1。所有受试均签署知情同意书,该研究方案获得了空军军医大学第二附属医院伦理委员会(批准编号:202105-17-KY-09-SJNK-02)的批准。
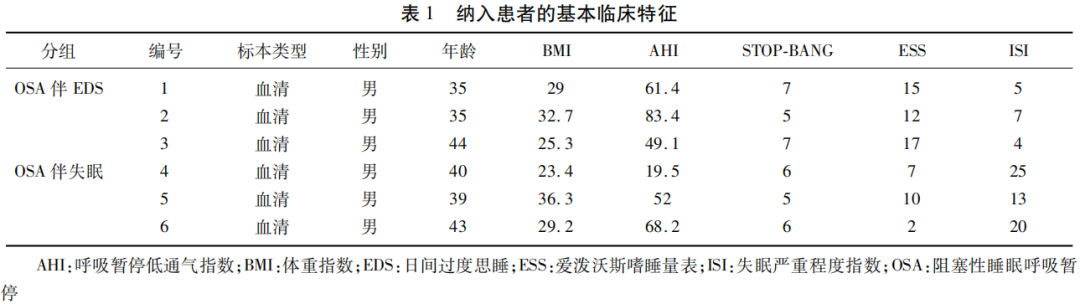
1.2 纳入与排除标准 OSA患者纳入标准:(1)符合国际睡眠障碍分类第3版(international classification of sleep disorders-third edition,ICSD-3)OSA诊断标准;(2)年龄25~45岁;(3)男性。排除标准:(1)近3月内发生过急性感染;(2)传染病、糖尿病、心脏病患者;(3)恶性肿瘤患者;(4)近期有过重大外伤或手术史。
使用计算机化PSG系统进行睡眠监测(Alice 4或5,respironics,pittsburgh,PA,USA)。技术员整夜值守,由1~2名专业技术人员手动评价所有睡眠研究数据,根据美国睡眠医学会睡眠分期和相关事件判读规则2.6版进行人工分期和事件判读,并由有经验的睡眠医师审签报告。通过PSG结果诊断OSA,纳入中重度OSA患者(AHI≥15次事件/h);通过睡眠量表评估患者症状,ESS总分>10分表明存在EDS症状;ISI总分>14分表明存在失眠症状。
1.3 血液标本采集 所有受试前一晚22:00后禁食水,次日晨07:00~08:00间空腹采集5 ml无菌静脉血液,收集于血清分离管中,使血液样品在室温下凝结2 h,然后在4 ℃以3 000 r/min离心10 min,将血清组份分装于EP管中,封口膜密封,保存在-80 ℃专用冰箱中备用。所有样品均一式两份留存。
1.4 Label-Free分析用样品准备 选择6份血清样品进行Label-Free相对定量蛋白质组学分析。在这6份血清样品中,3份来自OSA伴EDS患者,3份来自OSA伴失眠患者。所有样品收集完成后,从冰箱取出置于冰上解冻后高速离心。离心条件:温度4 ℃,12 000 r/min,离心10 min。取上清液转移至新的EP管中待测。本研究使用Proteo MinerTM试剂盒(伯乐)去除高丰度蛋白,利用BCA试剂盒进行蛋白浓度测定。然后进行丙酮沉淀、蛋白重溶、还原和烷基化。随后提取蛋白,评估蛋白质量,质检合格的蛋白进行Trypsin酶解,去除脱氧胆酸钠(sodium deoxycholate,SDC),多肽脱盐,然后对每个样品进行[JP3]nano-HPLC反相色谱分离和质谱(mass spectrum,MC)检测。所有操作均严格按照试剂盒说明书进行。
1.5 nano-LC-MS/MS 检测 每个样品取2 μg总肽经nano-UPLC 液相系统(EASYnLC1200)进行分离后联用配备纳升离子源的质谱仪(Q-Exactive HFX)进行数据采集。色谱分离采用100 μm ID×15 cm反相色谱柱(Reprosil-Pur 120 C18AQ,1.9 μm,Dr. Maisch)进行。流动相采用乙腈水甲酸体系,其中流动相A为0.1%甲酸98%水溶液(乙腈为2%),B相为0.1%甲酸80%乙腈溶液(水为20%)。色谱柱以100%的A相平衡后,样品由自动进样器直接上样到色谱柱,再经色谱柱梯度分离,流速300 nl/min,梯度时长120 min。流动相B比例:25%持续2 min,5%~22%持续88 min,22%~45%持续26 min,45%~95%持续2 min,95%持续2 min。
质谱分析使用数据依赖性采集(DDA)模式,总分析时长为120 min,采取正离子检测模式。一级扫描(Full scan)范围 350~1600 m/z,分辨率为120 k(@200 m/z),AGC为3E6,最大离子注入时间(max IT)为50 ms;一级扫描中强度最高的20个离子(top 20)经四极杆筛选后使用HCD 裂解后进行碎片离子扫描。四极杆隔离窗口(isolation window)为1.2 m/z,标准化碰撞能(NCE)为27%,AGC为1E5,max IT为110 ms。二级扫描分辨率15 k。根据色谱峰峰宽,动态排除时间设为45 s;单电荷及>6价的离子不进行二级扫描。
1.6 蛋白质数据库检索和统计分析 使用Proteome Discoverer(PD)软件(Version 2.4.0.305,Thermo Fisher Scientific)和内置的Sequest HT 搜索引擎处理原始MS文件。根据UniProt FASTA 数据库(uniprot-Homo sapiens-9606-2021-8.fasta)检索MS范围列表。酰胺甲基1[C]作为固定修饰,氧化(M)和乙酰基(Protein Nterm)作为可变修饰。胰蛋白酶用作蛋白酶。最多允许2次缺失裂解。可信度筛选标准设定为:错误发现率(false discovery rate,FDR)≤0.01。进行肽鉴别时,一级质谱精度设定为10 ppm,二级质谱精度为0.02 Da。采用肽段(Unique peptide和Razor peptide)进行蛋白定量,按总肽量进行归一化,所有其他参数均为默认值。定量结果标准化:保留唯一肽段数(Unique peptide)>1的为可信蛋白,在去除无效值和异常值后进行差异表达蛋白筛选。
使用 SPSS 26.0软件,每组3个独立重复样品,数据正态性通过直方图检验,组间差异蛋白比较采用f检验,得到的P值经FDR校正,校正后得到的P<0.05认为差异有统计学意义(双尾)。筛选出差异表达蛋白进行后续生物信息学分析。
1.7 生物信息学分析 首先对原始数据中的缺失值进行模拟,数值模拟方法为最小值二分之一法进行填补。随后通过主成分分析,判断不同样品间的关系。接着筛选差异表达的蛋白,在FDR<0.01前提下,满足差异表达蛋白筛选的标准为:t检验或卡方检验的P值<0.05且变化倍数(fold change,fc)≤0.83 或 fc≥1.2(上调超过1.2倍或下调超过0.83倍以上)。分析内容包括:数据预处理、差异表达蛋白筛选、主成分分析(principal component analysis,PCA)、火山图分析。对筛选出的差异蛋白行蛋白质层次聚类分析、对基因产物进行同源分类(cluster of orthologous groups of proteins,KOG分析)、亚细胞定位分析、蛋白质-蛋白质相互作用(protein-protein interaction network analysis,PPI)网络构建分析。
2 研究结果
2.1 蛋白鉴定和定量分析结果 采用 SDS-PAGE 结合考马斯亮蓝染色检测蛋白完整性,所检样品条带清晰分明、蛋白分子量分布均匀,表明保存完好,随后检测样品的色谱有效性及酶切效率。PCA结果提示,样品间重复性较好。共鉴定了641个蛋白,经过预处理后606个检测蛋白被保留。按照差异表达蛋白筛选的标准,OSA伴EDS组与OSA伴失眠组 34个蛋白有统计学差异,其中表达上调蛋白20个,表达下调蛋白14个。
OSA伴EDS组与OSA伴失眠组的差异蛋白主要集中于参与DNA损伤(DDI2、RAD23A)、活性氧清除(PRDX6)、免疫调节(C2、ALDH1A1)、炎症(AMBP)、能量代谢(APRT、AK1)等过程(见表2),OSA伴EDS患者血清DDI2、ALDH1A1、RAD23A、PRDX6、ST13P4、APRT、RAC3、MYH9、EIF5A2、AK1等蛋白表达上调,TUBB2A、补体C2、CCDC183、AMBP、TIMP3、IGKV6D-41等下调。
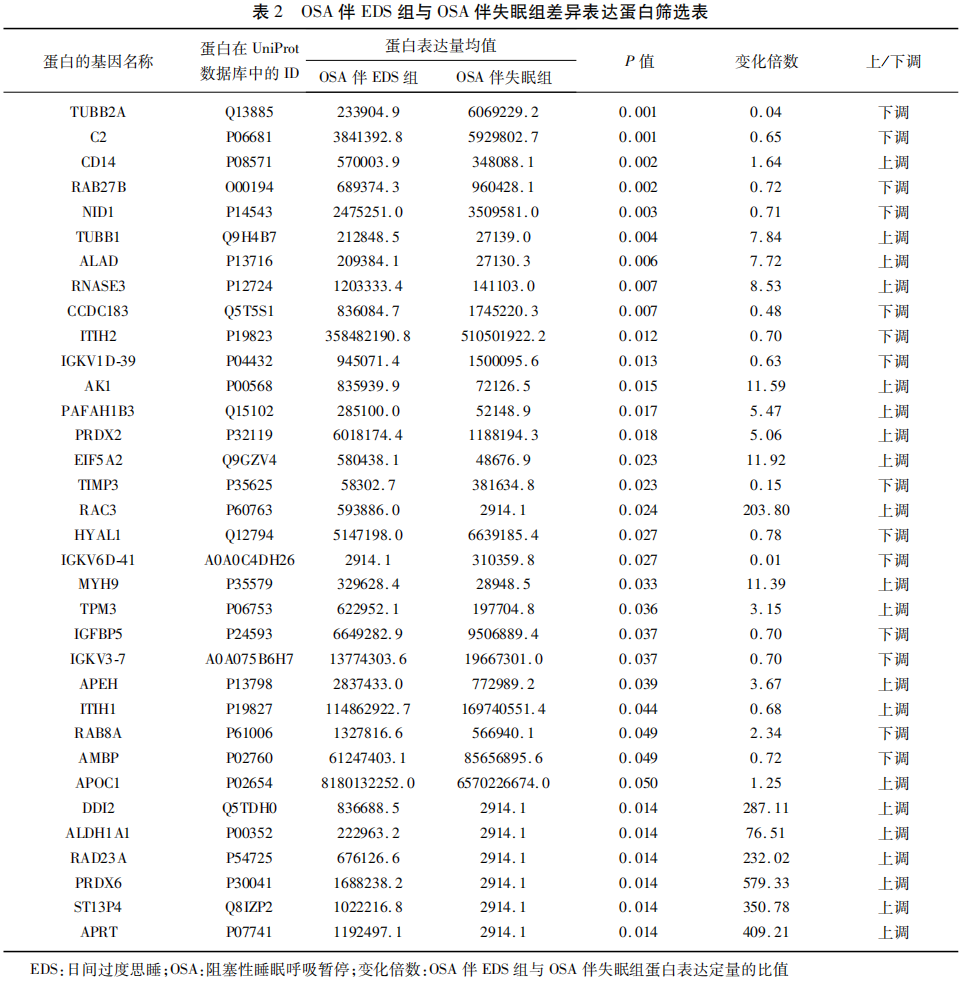
2.2 基于Label-free的蛋白质组学分析的一般信息 从表2可以看出,与OSA伴失眠患者相比,OSA伴EDS患者血清显著上调的蛋白有DDI2、RAD23A和PRDX6等,显著下调的蛋白有TUBB2A、补体C2、CCDC183等。其中PRDX6的上调差异表达倍数最高,其次为APRT。PRDX6具有修复发生过氧化的细胞膜的作用。
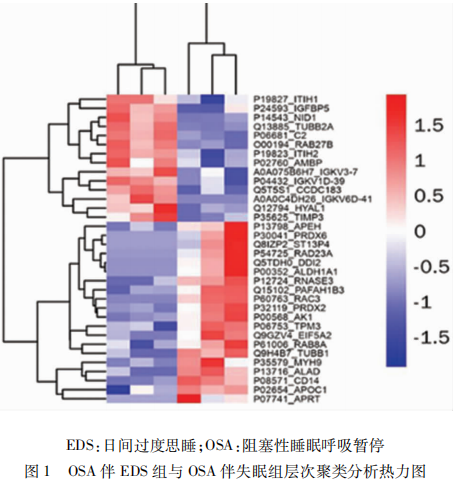
对OSA伴EDS组与OSA伴失眠组间34个差异表达蛋白进行了分层聚类分析(见图1)。图中横坐标每一列是指OSA患者样品,每一行代表鉴定的蛋白质。患者聚类树绘制在顶部。纵坐标代表该组对比的差异表达蛋白聚类。不同位置的色块代表对应位置蛋白的相对表达量,红色代表表达上调的蛋白,蓝色代表表达下调的蛋白。
从图1可以看出,OSA伴EDS组与OSA伴失眠组出现了明显的差异表达蛋白分组模式。在OSA伴EDS患者中,ITIH1、IGFBP5和NID1等蛋白表达水平相对较高,APEH、PRDX6和ST13P4等蛋白表达水平相对较低。而在OSA伴失眠患者中恰恰相反,也就是说,根据差异表达蛋白水平可将OSA患者分为明显不同的两个聚类。
2.3 差异表达蛋白功能分类 在OSA伴EDS与伴失眠患者的对比中,差异蛋白占比最高的聚簇涉及的主要功能为细胞内转运、分泌和囊泡转运、细胞骨架和信号转导。亚细胞定位分析结果显示差异表达蛋白主要定位在细胞质(47.06%)、分泌蛋白(38.24%)和细胞核(8.82%)中。
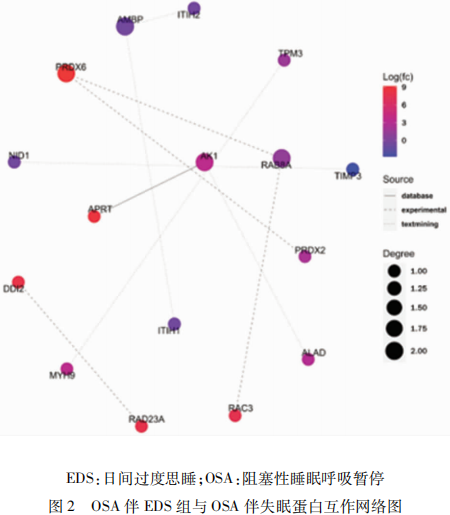
2.4 蛋白互作分析 筛选出前50位互作关系最紧密的蛋白绘制了蛋白互作网络(见图2)。图中颜色表示差异表达蛋白表达的水平,红色代表差异显著上调,蓝色代表差异显著下调;圈的大小表示差异表达蛋白的连接度,连接度越高圈越大;连线的类型代表互作关系来源,实线代表互作关系来自于数据库,虚线代表互作关系来自于实验,点线代表互作关系来自于文本挖掘。基于STRING数据库中的信息建立一个涉及16个差异表达蛋白的PPI网络。该网络包含16个节点和10条边。来自数据库分析的结果显示:APRT-AK1相互作用可能在OSA表现为不同临床亚型的发病机制中起作用。
3 讨论
本研究对伴EDS和伴失眠的OSA患者进行初步血清蛋白质组学分析,以试图发现潜在的生物标志物,并探索不同伴随症状亚型划分的分子机制。本研究在不同临床表型OSA患者中检测出34种差异表达蛋白。其中表达上调的有20个,表达下调的有14个。差异蛋白的主要功能集中于DNA损伤、活性氧清除、免疫调节和炎症反应,主要参与细胞内转运、分泌和囊泡转运等生物过程。此外,可能在OSA不同临床亚型中发挥重要作用的途径为APRT-AK1相互作用,可能代表着两种亚型患者的不同病理生理机制。蛋白质组学是评价疾病分子机制的策略之一。多组学相关OSA生物标志物已在部分研究中报道,包括微生物组学、代谢组学和脂质组学等,但有关OSA相关蛋白生物标志物的研究较少,且大多是在OSA患者和健康对照受试者中进行的,目前尚无在不同临床亚型中进行蛋白组学比较分析的研究。本研究纳入性别相同、年龄和BMI相近的患者,通过标准PSG获得AHI等睡眠参数对OSA进行诊断,在中、重度OSA患者中,采用Label-free相对定量蛋白质组学技术寻找可能与OSA不同亚型发病相关的蛋白,确定34种差异表达蛋白。发现DDI2、ALDH1A1和RAD23A等在伴EDS的OSA患者中表达上调,TUBB2A、补体C2、CCDC183表达下调。上述差异蛋白中,上调蛋白以DDI2、ALDH1A1和RAD23A表达变化倍数最大,因此,DDI2、ALDH1A1和RAD23A等可能可以作为OSA伴EDS和伴失眠两种不同亚型划分的生物标志物。蛋白质组学检测为OSA不同临床表型的识别提供诊断潜力,并为OSA的发病机制提供新见解。
既往研究中,Gozal等对60例OSA 患儿、30例原发性打鼾患儿和对照受试者(n=30)利用双向差异凝胶电泳法进行尿液蛋白质组学分析,找到16种与儿童OSA显著相关的蛋白,包括uromodulin、orosomucoid-1和kallikrein等。Zhang等分析了间歇性缺氧大鼠及OSA和非OSA受试者的血清细胞外微泡蛋白谱,并采用ELISA法进行了进一步验证。最终发现C-反应蛋白、结合珠蛋白和纤维连接蛋白在OSA组和非OSA 组之间的表达水平存在显著差异。间歇性低氧诱导突触可塑性损伤及认知功能障碍。在45~60岁的女性中,Lal等发现,与无认知障碍的OSA患者相比,在OSA受试者中观察到胰岛素、前列腺素、血管生成素-1、纤溶酶原激活物抑制剂-1和白细胞介素-1β在伴认知障碍的OSA患者中过表达。目前尚无DDI2、PRDX6、APRT、AK1、CCDC183等蛋白与OSA相关的研究报道。Cheng等对 OSA 患者血清进行了基于串联质量标签(TMT)的蛋白质组分析,发现OSA患者的差异表达蛋白富集在包括吞噬体和聚糖合成/降解和免疫反应在内的通路中,并发现ANTXR1、COLEC10、NCAM1、VNN1的蛋白水平与AHI呈负相关,而MAN1A1的蛋白水平与AHI呈正相关,该研究鉴定了不同严重程度OSA患者血清中的差异表达蛋白。Cederberg等的研究纳入1 391例受试者,使用高度多重基于适配子的阵列定量所有血浆样本中的5 000种蛋白,确定了84种与AHI相关的蛋白。上述研究在OSA患者中发现的差异表达蛋白多数无重合部分,可能与选择的患者人群不同、应用的检测方法不同、选定的健康对照不同等因素有关。
本研究发现,DDI2在OSA伴EDS亚型中表达上调,表明DDI2表达上调可能可以区分EDS亚型。DDI2为DNA损伤诱导同系物2,与多种细胞功能有关因其功能无特异性,因此在OSA不同亚型的机制解释方面效能不佳。下调蛋白以TUBB2A表达变化倍数最大,TUBB2A为微管蛋白2A Ⅱa类,表明TUBB2A改变可能与OSA不同共病发生相关,但TUBB2A的功能为参与有丝分裂和细胞内运输等过程,既往研究支持其基因突变在人脑的发育畸形中起作用。ALDH1A1蛋白对OSA无特异性,可能受到样本量小、存在相关合并症等的影响。RAD23A为紫外线切除修复蛋白,是一种多结构域支架蛋白,在泛素依赖性蛋白酶体降解中发挥重要作用;PRDX6是一种利用GSH作为辅助因子的非硒类过氧化物酶,具有修复发生过氧化的细胞膜的作用。Zhang等发现骨髓间充质干细胞来源的外泌体通过抑制心肌细胞铁死亡改善缺血再灌注(I/R)小鼠的心脏功能。骨髓间充质干细胞来源的外泌体通过调节Pum2/PRDX6轴抑制心肌细胞铁死亡,减轻I/R诱导的心脏损伤,从而改善心功能;APRT为腺嘌呤磷酸核糖转移酶,产生腺嘌呤作为多胺生物合成途径的副产物;AK1为腺苷酸激酶-1,参与能量代谢和不同细胞内腺嘌呤核苷酸比率的稳态,该基因编码一种腺苷酸激酶,参与能量代谢和不同细胞内腺嘌呤核苷酸比率的稳态,AK1基因在骨骼肌、大脑和红细胞中高度表达。OSA患者机体处于高水平的炎症状态,而炎症反应也是EDS的重要因素,负责免疫调节和炎症的蛋白质变化可能是OSA患者的特征。此外,既往研究也在失眠患者中发现促炎性细胞因子,如白细胞介素-6水平升高,本研究发现参与炎症反应的AMBP蛋白,在OSA伴失眠患者中表达上调,表明OSA伴失眠患者的炎症反应可能更重。但参与炎症反应的蛋白众多,可能其他具有显著差异的蛋白在OSA伴EDS患者中上调水平更高,因此,未来的研究应将差异蛋白按照功能分类,进一步探讨各种差异蛋白功能的总体效应。此外,有的差异蛋白,如ALDH1A1能发挥多种功能,如抗炎和细胞保护等,其结果取决于疾病和个体状态。 这些争议尚需进一步的研究来解决。目前差异蛋白是否对OSA患者具有保护作用仍需进一步研究,既往研究表明,OSA伴EDS患者具有更高的心血管事件发生风险,可能代表着一种更为严重的临床表型。因此,相较于OSA伴失眠、无或轻微症状OSA患者,OSA伴EDS患者涉及的疾病损害更大,但目前对于OSA患者的EDS症状缺乏有针对性和有效地治疗手段。OSA发病率高,危害大。因此,早期诊断和精准治疗具有重要意义。蛋白质组学变化可作为OSA不同临床亚型划分的生物标志物,可部分揭示发病机制。本研究采用蛋白质组学技术,以血清为样品,在OSA不同临床亚型OSA患者中,筛选出34个差异表达蛋白,这些差异表达蛋白主要与DNA损伤、活性氧清除、免疫调节和炎症反应等相关。OSA伴EDS患者血清DDI2、ALDH1A1表达均显著上调,而OSA伴失眠患者血清DDI2、ALDH1A1表达均下调,DDI2、ALDH1A1等对不同临床亚型OSA具有一定的诊断效能。对这些关键生物标志物的测量可能会增加患者症状特征的说服力,为选择个体化治疗策略提供信息。
本研究存在一定的局限性。首先,纳入的研究对象均为男性,OSA患者均AHI≥15次事件/h,因为OSA在男性群体中患病率更高,选择男性作为研究对象更具代表性,因此对于女性、老年、轻度OSA患者,应谨慎外推结果;相较于失眠患者及健康对照受试者,中、重度OSA可能具有的疾病特征更显著。其次,研究的样本量较小,鉴于本试验为初探性研究,目的是发现差异,利用差异蛋白的功能探讨可能的分子机制,未来应进行大样本、多中心临床研究及在实验动物模型中验证这些差异表达的蛋白,进一步阐明OSA不同临床亚型的发病机制。本研究的主要优势是在OSA不同临床亚型中检测了血清蛋白组学差异。根据临床症状和OSA不同亚型的特定血清标志物对患者进行评价,可为OSA的精准医疗助力。
参考文献
[1]Medicine American academy of sleep. ICSD3:international classification of sleep disorders-third edition (ICSD-3)[M]. Darien IL:American Academy of Sleep Medicine,2014.
[2]Benjafield AV,Ayas NT,Eastwood PR,et al. Estimation of the global prevalence and burden of obstructive sleep apnoea:a literature-based analysis[J]. Lancet Respir Med,2019,7(8):687-698.
[3]Gottlieb DJ,Punjabi NM. Diagnosis and management of obstructive sleep apnea:a review[J]. JAMA,2020,323(14):1389-1400.
[4]中国医师协会睡眠医学专业委员会. 成人阻塞性睡眠呼吸暂停多学科诊疗指南[J]. 中华医学杂志,2018,98(24):1902-1914.
[5]Patil SP,Ayappa IA,Caples SM,et al. Treatment of adult obstructive sleep apnea with positive airway pressure:an American academy of sleep medicine clinical practice guideline[J]. J Clin Sleep Med,2019,15(2):301-334.
[6]Craig S,Pépin JL,Randerath W,et al. Investigation and management of residual sleepiness in CPAP-treated patients with obstructive sleep apnoea:the european view[J]. Eur Respir Rev,2022,31(164):210230.
[7]Pieh C,Bach M,Popp R,et al. Insomnia symptoms influence CPAP compliance[J]. Sleep Breath,2013,17:99-104.
[8]Mokhlesi B,Finn LA,Hagen EW,et al. Obstructive sleep apnea during REM sleep and hypertension. results of the wisconsin sleep cohort[J]. Am J Respir Crit Care Med,2014,190(10):1158-1167.
[9]Zinchuk AV,Gentry MJ,Concato J,et al. Phenotypes in obstructive sleep apnea:a definition,examples and evolution of approaches[J]. Sleep Med Rev,2017,35:113-123.
[10]Owens RL,Macrea MM,Teodorescu M. The overlaps of asthma or COPD with OSA:a focused review[J]. Respirology,2017,22(6):1073-1083.
[11]Pien GW,Ye L,Keenan BT,et al. Changing faces of obstructive sleep apnea:treatment effects by cluster designation in the lcelandic sleep apnea cohort[J]. Sleep,2018,41(3):zsx201.
[12]Mazzotti DR,Keenan BT,Lim DC,el al. Symptom subtypes of obstructive sleep apnea predict Incidence of cardiovascular outcomes[J]. Am J Respir Crit Care Med,2019,200(4):493-506.
[13]Al-Amrani S,Al-Jabri Z,Al-Zaabi A,et al. Proteomics:concepts and applications in human medicine[J]. World J Biol Chem,2021,12(5):57-69.
[14]Berry RB,Quan SF,Abreu AR,et al. The AASM manual for the scoring of sleep and associated events:rules,terminology and technical specifications,version 2.6.darien,Illinois:American academy of sleep medicine[M]. 2020.
[15]Zhang X,Wang S,Xu H,et al. Metabolomics and microbiome profiling as biomarkers in obstructive sleep apnoea:a comprehensive review[J]. Eur Respir Rev,2021,30(160):200220.
[16]Du Z,Sun H,Du Y,et al. Comprehensive metabolomics and machine learning Identify profound oxidative stress and inflammation signatures in hypertensive patients with obstructive sleep apnea[J]. Antioxidants (Basel),2022,11(10):1946.
[17]Pinilla L,Benítez ID,Santamaria-Martos F,et al. Plasma profiling reveals a blood-based metabolic fingerprint of obstructive sleep apnea[J]. Biomed Pharmacother,2022,145:112425.
[18]Gozal D,Jortani S,Snow AB,et al. Two-dimensional differential in-gel electrophoresis proteomic approaches reveal urine candidate biomarkers in pediatric obstructive sleep apnea[J]. Am J Respir Crit Care Med,2009,180(12):1253-1261.
[19]Zhang H,Yang F,Guo Y,et al. The contribution of chronic intermittent hypoxia to OSAHS:from the perspective of serum extracellular microvesicle proteins[J]. Metabolism,2018,85:97-108.
[20][JP3]巩小蕾,吉维忠. 间歇性低氧诱导突触可塑性损伤及认知功能障碍的研究进展[J]. 中风与神经疾病杂志,2022,39(3):277-281.[JP]
[21]Lal C,Hardiman G,Kumbhare S,et al. Proteomic biomarkers of cognitive impairment in obstructive sleep apnea syndrome[J]. Sleep Breath,2019,23(1):251-257.
[22] Cheng H,Jin S,Huang S,et al. Serum proteomic analysis by tandem mass tag-based quantitative proteomics in pediatric obstructive sleep apnea[J]. Front Mol Biosci,2022,9:762336.
[23] Cederberg KLJ,Hanif U,Peris Sempere V,et al. Proteomic biomarkers of the apnea hypopnea index and obstructive sleep apnea:insights into the pathophysiology of presence,severity,and treatment response[J]. Int J Mol Sci,2022,23(14):7983.
[24]Maillard C,Roux CJ,Charbit-Henrion F,et al. Tubulin mutations in human neurodevelopmental disorders[J]. Semin Cell Dev Biol,2023,137:87-95.
[25]Zhang JK,Zhang Z,Guo ZA,et al. The BMSC-derived exosomal lncRNA Mir9-3hg suppresses cardiomyocyte ferroptosis in ischemia-reperfusion mice via the Pum2/PRDX6 axis[J]. Nutr Metab Cardiovasc Dis,2022,32(2):515-527.
[26]Lal C,Weaver TE,Bae CJ,et al. Excessive daytime sleepiness in obstructive sleep apnea[J]. Mechanisms and Clinical Management. Ann Am Thorac Soc,2021,18(5):757-768.
[27]Spiegel K,Leproult R,Van Cauter E. Impact of sleep debt on metabolic and endocrine function[J]. Lancet,1999,354(9188):1435-1439.
[28]Mazzotti DR,Keenan BT,Lim DC,et al. Symptom subtypes of obstructive sleep apnea predict incidence of cardiovascular outcomes[J]. Am J Respir Crit Care Med,2019,200(4):493-506.
作者信息
基金项目: 国家重点研发计划“常见多发病防治研究”专项“睡眠-觉醒障碍预警和诊疗体系研究”项目(2021YFC2501401和2021YFC2501405)
作者单位: (空军军医大学第二附属医院神经内科,陕西 西安 710038)
通讯作者: 宿长军,E-mail:changjunsu@163.com
引用
引证本文:张丽萍,赵显超,程金湘,等. 阻塞性睡眠呼吸暂停不同症状亚型患者血清蛋白质组学分析[J]. 中风与神经疾病杂志,2023,40(3):195-201.

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)