首页 > 医疗资讯/ 正文
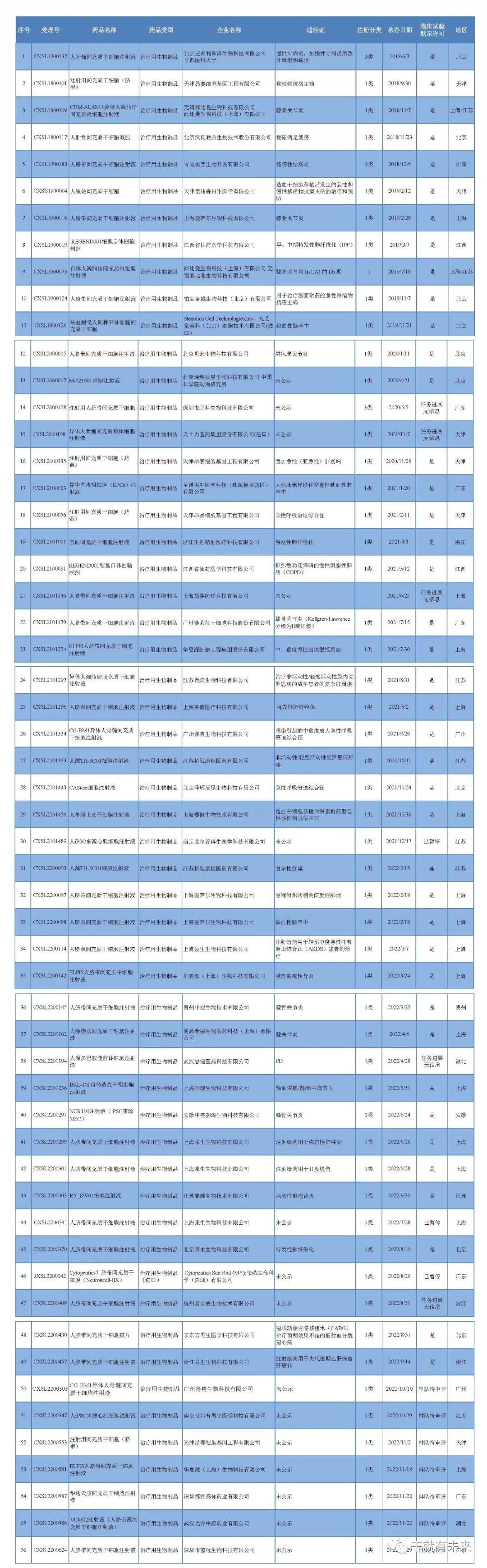
截至2023年2月28日,国内共有42家企业(不含子公司)的62款干细胞药物临床试验申请(IND)获得受理,共有30家企业(不含子公司)的47款获准默许进入临床试验(临床试验默示许可)。62款受理干细胞药物中有8款已无法查到IND评审信息或评审暂停,7款正在评审中。
2月份,新增3家企业的4种干细胞药物临床试验申请获得受理,新增3款干细胞药物通过默示许可,新增受理及默示许可均为间充质干细胞。
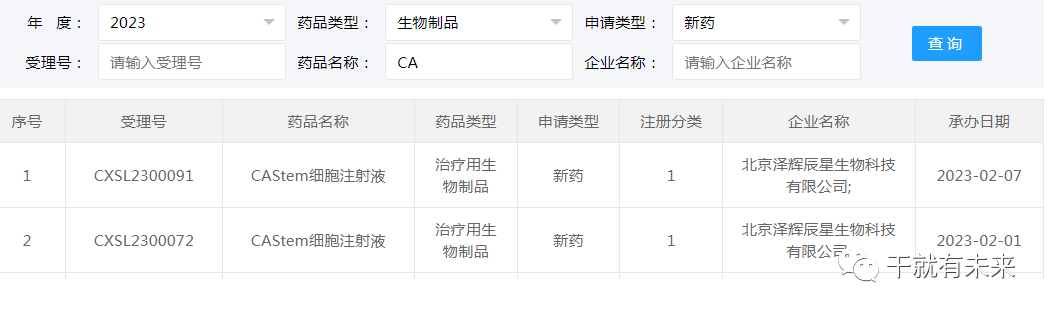
▉ 干细胞药物新增受理2023年2月1日与2023年2月7日,北京泽辉辰星生物科技有限公司“CAStem细胞注射液”(人胚干细胞分化而来的类间充质干细胞)的2项药物临床试验申请获受理(受理号分别为:CXSL2300072、CXSL2300091)。这是该干细胞注射液的第2和第3种适应证,此前急性呼吸窘迫综合征的临床试验申请已于2021年11月24日获得受理(受理号:CXSL2101443),目前处于CDE审评阶段。
 ▲图片来源:CDE官网
▲图片来源:CDE官网
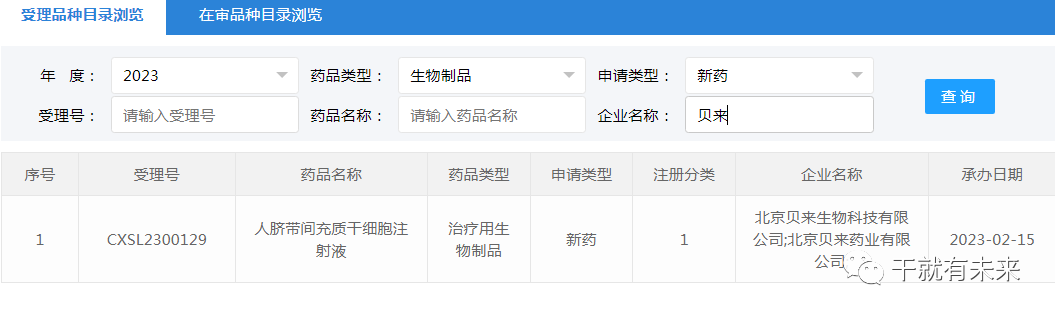
2023年2月15日,北京贝来生物科技有限公司“人脐带间充质干细胞注射液”的药物临床试验申请获受理(受理号:XSL2300129)。这是该干细胞注射液的第3种适应证,此前已获得默示许可用于类风湿关节炎(受理号:CXSL2000005)和特发性肺纤维化(受理号:CXSL2200370),目前处于CDE审评阶段。
 ▲图片来源:CDE官网
▲图片来源:CDE官网
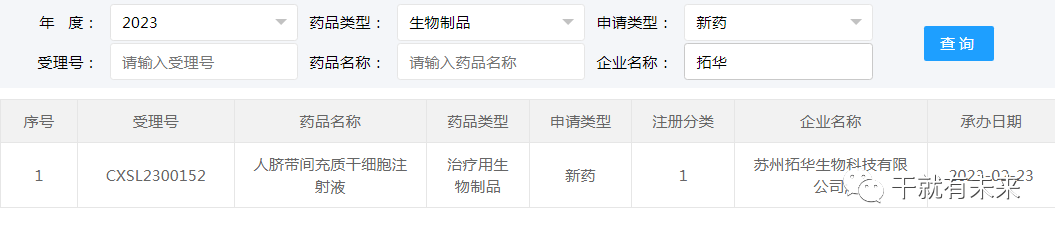
2023年2月23日,苏州拓华生物科技有限公司“人脐带间充质干细胞注射液”的药物临床试验申请获受理(受理号:CXSL2300152)。这是该干细胞注射液的第1种适应证,目前处于CDE审评阶段。
 ▲图片来源:CDE官网
▲图片来源:CDE官网
▉ 干细胞药物新增默示许可
据2023年2月28日CDE官网显示,华夏源(上海)生物科技有限公司的“ELPIS人脐带间充质干细胞注射液”(受理号:CXSL2200581)获得新药临床试验默示许可,适应证为:慢加急性(亚急性)肝衰竭。这是该干细胞注射液的第3种适应证,此前已获得默示许可用于中、重度慢性斑块型银屑病(受理号:CXSL2101224)、重度狼疮性肾炎(受理号:CXSL2200142)的临床试验。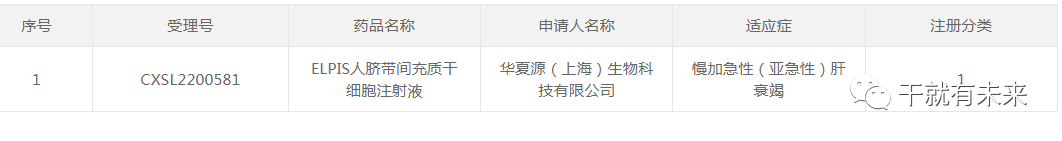 ▲图片来源:CDE官网
▲图片来源:CDE官网
 ▲图片来源:CDE官网
▲图片来源:CDE官网

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)