首页 > 医疗资讯/ 正文
使用DNA拓扑异构酶I抑制剂DXd/SN-38的抗体药物偶联物(Antibody-drug conjugates, ADCs)已经改变了癌症治疗,但需要更有效的ADCs来克服耐药。
2023年1月24日,普众发现医药科技(上海)有限公司孟逊团队在Cancer Discovery 杂志在线发表题为“Antibody-exatecan conjugates with a novel self-immolative moiety overcome resistance in colon and lung cancer”的研究论文,该研究设计了一个ADC类,使用一种新型的自我牺牲T部分,用于exatecan的无踪偶联和释放,exatecan是一种更有效的拓扑异构酶I抑制剂,对多药耐药(multidrug, MDR)的敏感性较低。靶向HER2、HER3、TROP2的抗体-T moiety-exatecan(依喜替康)偶联物在低靶点表达、大肿瘤和MDR+肿瘤中克服了等效DXd/SN-38 adc的固有或治疗耐药性,具有治疗指标增强、稳定性提高和肿瘤内药效反应改善等特点。
T moiety-exatecan ADCs在PDX和类器官模型中表现出持久的抗肿瘤活性,代表了未满足的临床需求,包括EGFR-del19/T790M/C797S三突变肺癌和BRAF/ KRAS-TP53双突变结肠癌,并与PARP/ATR抑制剂和抗PD -1治疗显示协同作用。总之,该研究表明T moiet -exatecan ADC类在非人灵长类动物中的高耐受性支持其在现有ADC之外扩大响应患者群体和肿瘤类型的潜力。

抗体药物偶联物(ADCs)在抗体载体上提供靶向肿瘤细胞的细胞毒性药物(“有效载荷”)。随着十多种药物的批准(过去几年有7种)和更多的临床开发,ADC正在经历复兴。这一突破主要是由变革性ADC设计驱动的,该设计使用了低效但更安全的负载DNA拓扑异构体酶I (TOP1)抑制剂喜树碱(SN38或DXd)和更高的药物负载(DAR 8)来提高治疗指数。允许使用更高剂量的ADC (~ 5-10 mg/kg)来改善药物输送和组织穿透,而不会产生更大的毒性。
HER2靶向T-DXd/DS-8201a由高度稳定的肽连接子GGFG和有效负载DXd组成,DXd是喜树碱exatecan的衍生物,其效力比微管靶向或DNA烷基化剂低10-100倍。然而,其强大的旁观者杀伤效应克服了对T-DM1/Herceptin的耐药性,使其成为第一个对低HER2表达肿瘤有效的ADC。IMMU -132 (Trodelvy)使用另一种TOP I抑制剂SN-38作为有效载荷,靶向TROP2,是治疗三阴性乳腺癌的首个有效ADC。其他GGFG-DXd ADCs,包括靶向HER3的U3-1402 (PatritumabDXd)和靶向TROP2的Dato-DXd,在患者中显示出有希望的治疗结果,突出了使用喜树酸类似物作为ADC载荷的前所未有的临床成功。
尽管取得了突破,但由于肿瘤异质性和多药耐药(multidrug resistance, MDR)调控,DXd和SN-38 ADCs面临着固有和获得性耐药。由于肿瘤的异质性,负载敏感型肿瘤患者的典型治疗有效率仅为30-50%,因为低靶点表达或高瘤内异质性导致更耐药的肿瘤。DS-8201a在HER2低表达乳腺癌和胃癌中的初始反应分别小于50%和30%。在非小细胞肺癌(non-small cell lung cancer, NSCLC)中,DS-8201a可改善HER-2过表达(IHC 3+和2+)患者T-DM1的反应率,但ORR仍低于30%。
在临床前研究中,靶向HER3和TROP2的DXdADCs在低靶点表达的肿瘤中同样无效。在临床试验中,U3-1402对表达HER3- EGFR突变的非小细胞肺癌患者有效,ORR为39%,HER3表达较高的患者往往有更好的反应。初始反应后靶突变导致TROP2下调可导致Trodelvy获得性耐药。此外,某些肿瘤类型可能对DXd-ADCs更具挑战性,因为在DS-8201a试验中,大多数结肠癌病例(HER2低)未观察到有意义的反应。此外,由于MDR转运体ABCG2或pg-p的DXd/SN-38外排量较高,DXd/SN-38 ADCs在MDR+肿瘤中可能无效。描述与当前基于TOP I抑制剂的ADC类相关的固有耐药机制和设计克服局限性的ADC在临床上是必要的。
结合一种新型自我牺牲部分和拓扑异构酶I抑制剂exatecan作为有效载荷的ADCs,在低靶点表达和耐药的MDR+肿瘤中表现出深度和持久的反应,而不增加毒性。这种新的ADCs特许经营权有可能使更多的患者群体受益,超出目前的选择。
为了实现这一目标,该研究在这里设计了一种抗体-exatecan偶联类,通过生物化学和药理学分析exatecan与DXd/SN-38作为ADC有效载荷,其治疗指数优于DXd/SN-38。引入了一种与临床证明的ADCs连接剂兼容的新型化学物质(T部分),以掩盖exatecan疏水性,实现无迹共轭和exatecan释放。与DXd/SN-38 ADCs相比,T部分(T800-T1000)将优越的exatecan有效载荷特征转化为具有改善的物理化学和药理性能的ADCs,表现出更高的稳定性,更深的肿瘤穿透和更持久的抗肿瘤反应。
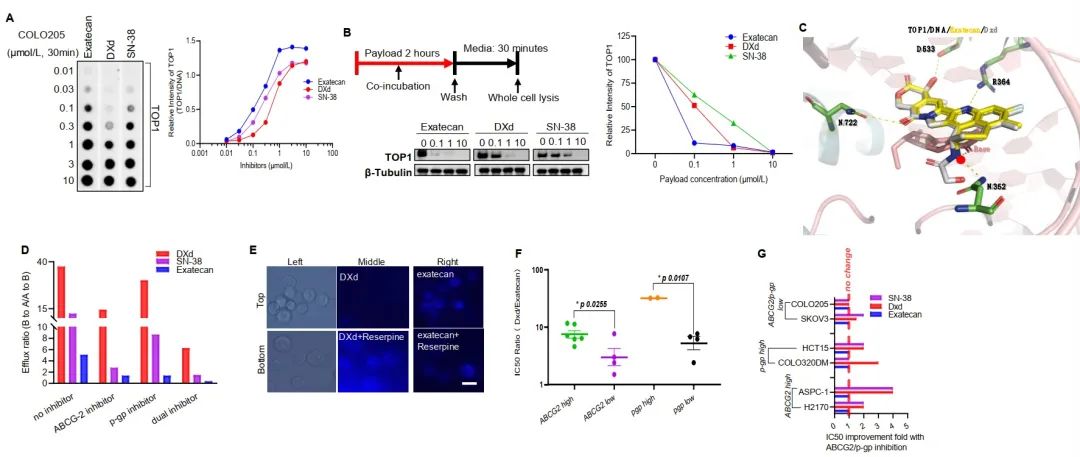
图1. Exatecan效价、MDR敏感性和毒性(图源自Cancer Discovery )
不仅如此,T moiey -exatecan ADCs由于具有更高的瘤内药效学反应,对大尺寸肿瘤更有效,并且能够克服体内对DXd/SN-38 ADCs的MDR+(高ABCG2/p-gp表达)肿瘤耐药性,包括具有挑战性的患者来源的异种移植和类器官模型。尽管T moiety-exatecan ADCs具有更高的效力,但在非人类灵长类动物中并没有产生更高的毒性。
进一步通过联合治疗的初步探索表明exatecan及其ADCs与DNA损伤反应(DDR)通路抑制剂在结肠癌中的协同疗效更好。研究数据表明,与先前的ADCs相比,T moiet -exatecan ADCs可能克服耐药机制,在更多的患者群体和更广泛的肿瘤中引起反应。
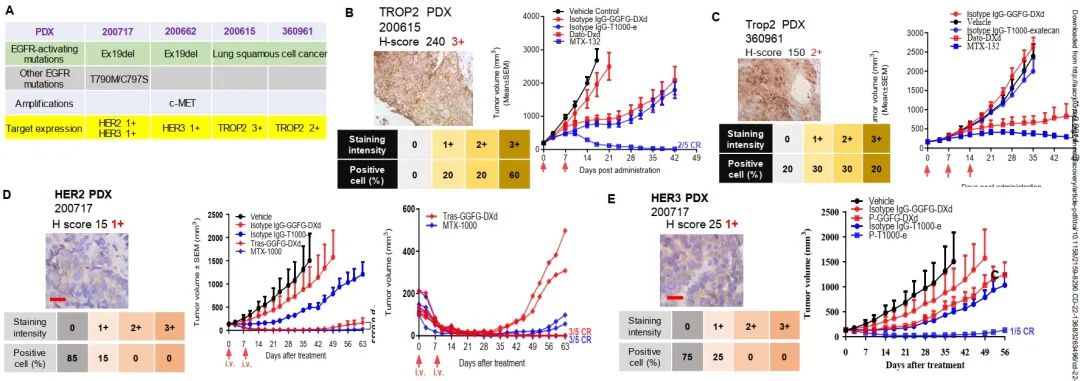
图2. T moiety-exatecan ADCs靶向肺癌耐药性(图源自Cancer Discovery )
综上所述,这项研究表明结合一种新型自我牺牲部分和拓扑异构酶I抑制剂exatecan作为有效载荷的ADCs在低靶点表达和耐药的MDR+肿瘤中表现出深度和持久的反应,而不增加毒性。这种新的ADCs特许经营权有可能使更多的患者群体受益,超出目前的选择。
原文链接:
https://doi.org/10.1158/2159-8290.CD-22-1368
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)