首页 > 医疗资讯/ 正文
近日,来自首都医科大学宣武医院国家老年病临床医学研究中心神经内科、老年病学与神经生物学科的杨秋梅团队在Journal of Cachexia Sarcopenia Muscle杂志在线发表了题为“α-Synuclein aggregation causes muscle atrophy through neuromuscular junction degeneration”的文章。该研究团队发现,α-突触核蛋白聚集在调节神经肌肉接头释放乙酰胆碱和诱导肌内线粒体氧化应激当中起着重要作用。
 帕金森病(PD)是老年人常见的神经退行性疾病。随着病情的进展,PD患者可出现不同程度的肌无力、肌疲劳、肌疼痛和肌萎缩等症状。相关症状中,当肌肉容积减少到正常人肌容积 10-20%,并伴肌力下降或功能受损时,我们将之称为少肌症。少肌症会增加患者跌倒、致残风险;在 PD 患者中,伴少肌症的 PD 患者跌倒频率明显高于不伴少肌症的PD患者。不过目前对PD 患者肌萎缩发生的机制研究较少。
帕金森病(PD)是老年人常见的神经退行性疾病。随着病情的进展,PD患者可出现不同程度的肌无力、肌疲劳、肌疼痛和肌萎缩等症状。相关症状中,当肌肉容积减少到正常人肌容积 10-20%,并伴肌力下降或功能受损时,我们将之称为少肌症。少肌症会增加患者跌倒、致残风险;在 PD 患者中,伴少肌症的 PD 患者跌倒频率明显高于不伴少肌症的PD患者。不过目前对PD 患者肌萎缩发生的机制研究较少。
既往研究发现,少肌症患者骨骼肌中的存在线粒体氧化应激的现象。而在 PD 中,α-突触核蛋白(α-Syn)聚集诱导氧化应激是其关键致病过程。由于α-突触核蛋白的表达并不局限于大脑,同时也表达于骨骼肌和心脏中。那么,PD 患者的少肌症是否与外周分布的α-突触核蛋白有关呢?具体来看是通过哪种途径起作用的呢?围绕这一科学问题,作者进行了以下实验。
首先,作者构建了过度表达α-突触核蛋白基因的转基因小鼠(mThy1-hSNCA),发现6个月的mThy1-hSNCA转基因小鼠在大体形态和肌肉重量上与正常同窝对照小鼠无明显区别,但20个月大mThy1-hSNCA小鼠可观察到肌纤维形态不规则,体积变小,核内移,肌纤维溶解,肌纤维化增加以及糖原含量减少等现象(图1)。
通过免疫组化和荧光共定染色作者发现,过度表达的α-突触核蛋白过在mThy1-hSNCA小鼠肌肉中形成聚集。但体外实验表明,α-突触核蛋白并不在原代成肌细胞中表达;相反,它在由成纤维细胞、内皮细胞和神经元细胞组成的非生肌细胞中高表达。同时,研究团队发现α-突触核蛋白过度表达并未影响早期调节骨骼肌功能的神经元数量,但会引起神经元变性。
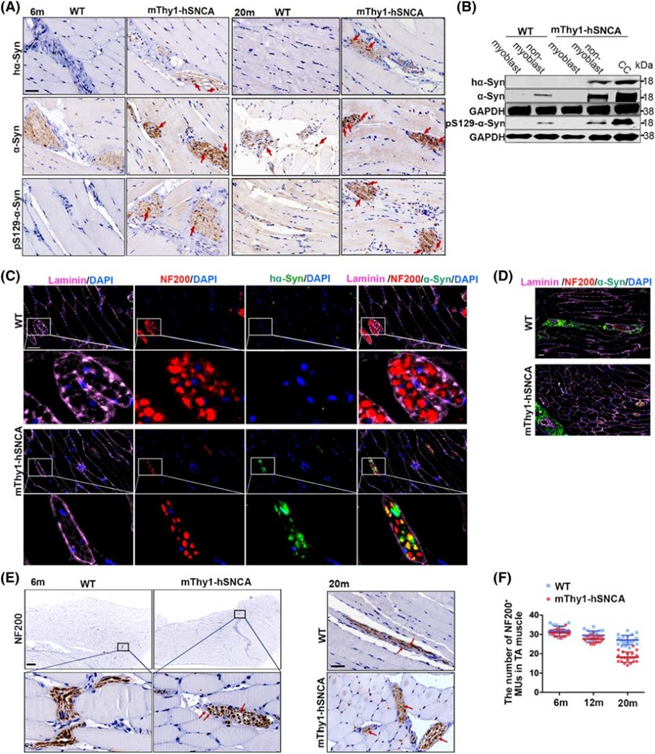 图1
图1
接下来,作者通过进一步研究发现 mThy1-hSNCA小鼠的肌内轴突和神经肌接头(NMJs)处存在线粒体受损,线粒体氧化应激增加。利用AAV9-hSyn-ACh2.0探针示踪剂显示发现mThy1-hSNCA小鼠肌肉中分泌的ACh减少,乙酰胆碱受体(AChR)片段化比例增加。同时,作者通过建立损伤模型发现α-突触核蛋白聚集导致肌肉内氧化应激增加。且转录组学发现mThy1-hSNCA 小鼠中,与 NMJ 活性、神经传递和活性氧 (ROS) 代谢过程调节相关的基因表达显着降低,导致 ROS 产生增加。加剧的氧化应激改变了线粒体与肌节结构的空间关系,增加了肌纤维细胞凋亡,改变了肌肉卫星细胞 (MuSC) 的代谢特征(包括基础呼吸能力和糖酵解能力),并减少肌肉再生过程中的细胞迁移和融合。Mito-TEMPO (MT)是一种可以可减轻氧化应激的药物。作者发现,在 mThy1-hSNCA 小鼠中使用 MT 可以修复 mThy1-hSNCA 小鼠的骨骼肌再生障碍。
综上所述,作者发现NMJs 中α-突触核蛋白的积累导致肌内氧化应激和肌肉萎缩。这些新发现表明PD是一种全身性疾病,不仅累及大脑中的多巴胺能神经元和神经胶质细胞,还会对外周免疫细胞和骨骼肌等其他器官造成损害。这些发现为帕金森病患者肌肉萎缩的病因学提供新的见解。由于肌肉萎缩会加剧 PD 的恶化和严重程度,这些结果也可以为今后临床PD肌肉萎缩的有效干预和治疗提供实验依据。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)