首页 > 医疗资讯/ 正文
Hanahan等[1]于2011年首次提出肿瘤免疫逃逸这一新兴特征,并于2022年1月再次总结了肿瘤发生发展机制及治疗策略[2],其中包括免疫检查点抑制剂(ICIs),该类药物通过激活机体自身免疫应答发挥抗肿瘤作用。
近年来,针对细胞毒性 T 淋巴细胞相关蛋白4 (CTLA-4)、程序性死亡[蛋白]-1 (PD-1)及其配体- 1(PD-L1)等免疫检查点相关抑制剂在肿瘤的免疫治疗方面取得了一定进展,开启了肿瘤治疗的新时代。本文就CTLA-4单抗在晚期实体肿瘤中的临床治疗进展进行综述,以期为肿瘤的免疫治疗提供参考。
1 免疫检查点抑制剂及其作用机制
免疫检查点是维持自身免疫稳态的免疫调节因子,可调节机体免疫应答[3]。正常情况下,肿瘤细胞使部分免疫检查点失活,造成抗肿瘤免疫反应失调,从而促进肿瘤生长和增殖。而ICIs可通过抑制免疫检查点介导的免疫耐受,增强免疫细胞活性,激活机体自身的免疫应答,从而发挥抗肿瘤作用。
目前,以PD-1/PD-L1为代表性的ICIs类药物广泛用于临床治疗,包括PD-1抑制剂(Pembrolizumab、Nivolumab)和PD-L1抑制剂(Atezolizumab、Durvalizumab)等。
除此之外,ICIs类药物还包括CTLA-4单抗(Ipilimumab、Tremelimumab)、淋巴细胞活化基因3(LAG-3)单抗(Relatlimab)[4]、T细胞免疫球蛋白(T cell immunog-lobulin)和免疫受体酪氨酸抑制基序(ITIM)结构域单抗(Tiragolumab)[5]等。
相较于PD-1/PD-L1抑制剂单药在肿瘤治疗领域的广泛应用,CTLA-4抑制剂在双免疫疗法中的应用丰富了肿瘤免疫治疗方式,其中以PD-1/PD-L1抑制剂联合CTLA-4抑制剂的双免疫疗法最为常见。
1.1 CTLA-4抑制剂
CTLA-4(CD152)与CD28同源,均表达于活化的CD4+和CD8+ T细胞表面,CD28与其配体B7-1/2结合后产生刺激性信号,激活TCR信号通路,使CTLA-4高表达并竞争性结合B7-1/2,抑制白细胞介素(IL)-2分泌,从而发挥负性调控作用[6-9]。
此外,CTLA-4与CD80/CD86结合可抑制T细胞活化,而调节性T(Treg)细胞可通过CTLA-4下调CD80/CD86的表达水平,进而抑制CD28共刺激信号通路[10-11]。CTLA-4抑制剂通过上述机制发挥抗肿瘤作用[12],阻止Treg细胞下调CD80/86表达水平[13],并通过抗体依赖性细胞介导的细胞毒性作用(ADCC)及吞噬作用(ADCP)耗竭Treg细胞,从而增加CD4+/CD8+T细胞对肿瘤组织的浸润,同时使记忆T细胞克隆性增多[14-17]。
1.2 CTLA-4联合PD-1/PD-L1抑制剂
PD-1/PD-L1或CTLA-4单抗治疗的反应率均较低,而二者联合治疗的反应率升高,联合治疗作用机制可能为:
(1)增加CD4+/CD8+T细胞对肿瘤组织的浸润,从而提高CD4+/CD8+T细胞与Treg细胞的比例,发挥抗肿瘤作用;
(2)同时作用增强共刺激,从而进一步促进T细胞活化,且由于CTLA-4与PD-1细胞内信号传导均与PI3K/AKT/mTOR信号通路相关,可同时阻断双免疫检查点[18-21]。
2 抗CTLA-4治疗
与PD-1/PD-L1单抗相比,CTLA-4单抗类药物虽然起步与临床应用较早,但药物种类较为单一且多联合其他ICIs使用。目前仅Ipilimumab获得美国食品药品监督管理局 (FDA)批准用于肿瘤的临床治疗,也是首个被证实可延长晚期黑色素瘤患者总生存期 (OS) 的药物[22]。
2.1 CTLA-4单药治疗
一项Ipilimumab联合黑色素瘤相关糖蛋白(HLA-A*0201)治疗黑色素瘤的疗效及安全性临床试验(MDX010-20)研究表明,联合治疗与Ipilimumab单药治疗的生存获益均优于对照组,可显著延长黑色素瘤患者的中位OS(mOS),Ipilimumab于2011年5月获美国FDA批准上市[22]。
一项Ipilimumab与安慰剂用于黑色素瘤术后辅助治疗的Ⅲ期临床试验(CA184-029)研究表明,Ipilimumab可降低28%的黑色素瘤患者死亡风险,5年生存率为65.4%,中位随访6.9年时各项生存获益仍持续存在,且各亚组的长期获益一致,于2015年10月获美国FDA批准用于黑色素瘤术后辅助治疗[23]。
2.2 “O+Y”联合治疗
2.2.1 一线治疗
(1)黑色素瘤:一项Ⅱ期临床试验(CheckMate-069)研究表明,与Ipilimumab单药治疗相比,“O+Y”[Nivolumab(PD-1单抗)+Ipilimumab(CTLA-4单抗)]联合治疗BRAF 野生型患者客观缓解率(ORR)与完全缓解率均较高(61%比11%,22%比0),“O+Y”联合治疗BRAF 突变型患者中位无进展生存期(mPFS)显著延长(8.5个月比2.7个月),于2015年9月获FDA批准用于治疗不可切除或转移性BRAF 野生型黑色素瘤[23]。
“O+Y”联合治疗与Ipilimumab及Nivolumab单药治疗不可切除黑色素瘤患者的临床试验(CheckMate-067)表明[24],联合治疗PFS及OS均优于单药治疗组,可显著改善mOS,于2016年1月获美国FDA批准用于治疗不可切除黑色素瘤。
(2)肾细胞癌:一项随机、开放性Ⅲ期临床试验(CheckMate-214)研究表明[25],与Sunitinib 单药治疗相比,“O+Y”联合治疗使中高风险肾细胞癌患者OS由26.6个月延长至47个月,死亡风险下降34%,PFS由8.3个月延长至12个月,进展或死亡风险降低24%,于2018年4月获美国FDA批准用于治疗晚期或转移性肾细胞癌。
(3)非小细胞肺癌(NSCLC):一项治疗EGFR/ALK阴性晚期NSCLC的Ⅲ期临床试验(CheckMate-227)研究结果于2021年美国临床肿瘤学会(ASCO)年会公布,详见表1[26-27]。
表1 CheckMate-227临床试验结果

另有一项Ⅲ期临床试验(CheckMate-9LA)表明[28],与单纯化疗相比,“O+Y”联合治疗+2周期化疗的mOS、2年总生存率、mPFS、中位持续缓解时间 (DOR)均较高(15.8个月比11.0个月,38% 比26%, 6.7个月比5.3个月,13.0个月比5.6个月),基于上述两项研究,“O+Y”联合治疗于2021年5月获美国FDA批准用于治疗EGFR/ALK阴性晚期NSCLC。
(4)恶性胸膜间皮瘤(MPM):一项Ⅲ期临床试验(CheckMate-743)研究表明[29],与单纯化疗相比,“O+Y”联合治疗可显著延长MPM患者的mOS(18.1个月比14.1个月),提高2年总生存率(41%比27%),有效改善MPM患者的生存获益,随访35.5个月即患者停药1年后,3年总生存率是单纯化疗的1.5倍(23.2% 比15.4%),死亡风险降低27%,为首个且唯一证明“O+Y”联合治疗可改善生存获益的临床试验,并打破了MPM 15年内缺乏新药的僵局,于2020年10月获美国FDA批准用于MPM的治疗。
(5)晚期肝细胞癌(HCC):一项治疗HCC 的Ⅲ期临床试验(HIMALAYA)结果显示[30],相较于索拉非尼(Sorafenib)单药治疗,“D+T”[Durvalizumab(PD-L1单抗)+Tremelimumab(CTLA-4单抗)]联合治疗的mOS较高(16.4个月比13.8个月,HR=0.78,95% CI:0.66~0.92,P=0.0035),mPFS分别为3.8 个月和4.1个月,ORR分别为20.1% 和5.1%,3年总生存率分别为30.7%和20.2%,于2022年10月获美国FDA批准用于HCC的一线治疗。
2.2.2 二线及后线治疗
(1)转移性结直肠癌(mCRC):一项临床试验(CheckMate-142)研究表明[31],119例曾接受氟尿嘧啶+奥沙利铂或伊立替康治疗,且为高度微卫星不稳定(MSI-H)/错配修复缺陷(dMMR)转移性mCRC患者接受4周期“O+Y”联合治疗后序贯Nivolumab 3 mg/kg,每2周治疗直至病情进展或死亡。入组患者的BRAF和KRAS突变率分别为24%和37%,研究显示ORR为49%,其中完全缓解率和部分缓解率分别为4%和45%,“O+Y”联合治疗于2018年7月获美国FDA批准。
(2)HCC:一项Ⅰ/Ⅱ期、多队列研究(CheckMate-040)中队列1、2研究针对Nivolumab剂量爬坡与扩展试验[32]结果显示未接受Sorafenib治疗的一线治疗和接受过Sorafenib治疗的二线治疗ORR分别为20%~23%和16%~19%,一线初治患者mOS达28.6个月, 二线经治患者mOS分别为15.6个月(扩展组)和15个月(递增组),于2017年9月获美国FDA批准用于HCC二线治疗,2019年ASCO年会公布了队列4研究对于“O+Y”联合治疗在曾接受Sorafenib治疗的HCC患者中的安全性及有效性研究结果,HCC患者ORR为31%,mDOR为17.5个月,疾病控制率为49%。基于上述研究结果,“O+Y”联合治疗于2020年3月获美国FDA批准。
(3)宫颈癌:一项Ⅱ期临床试验结果显示,我国自主研发的卡度尼利(Candonilimab)单抗[33]用于治疗既往接受含铂化疗失败的复发或转移性宫颈癌患者的ORR为33.0%,随访6个月及12个月时中位持续缓解率分别为77.6%和52.9%。
mPFS为3.75个月,mOS为17.51个月,3级及以上不良事件(adverse event, AE)发生率为27.0%,该药物于2022年6月获我国国家药品监督管理局(NMPA)批准附条件上市。CTLA-4及“O+Y”联合治疗获美国FDA/我国NMPA批准的适应证见表2。
表2 CTLA-4及“O+Y”联合治疗获美国FDA/我国NMPA批准的适应证
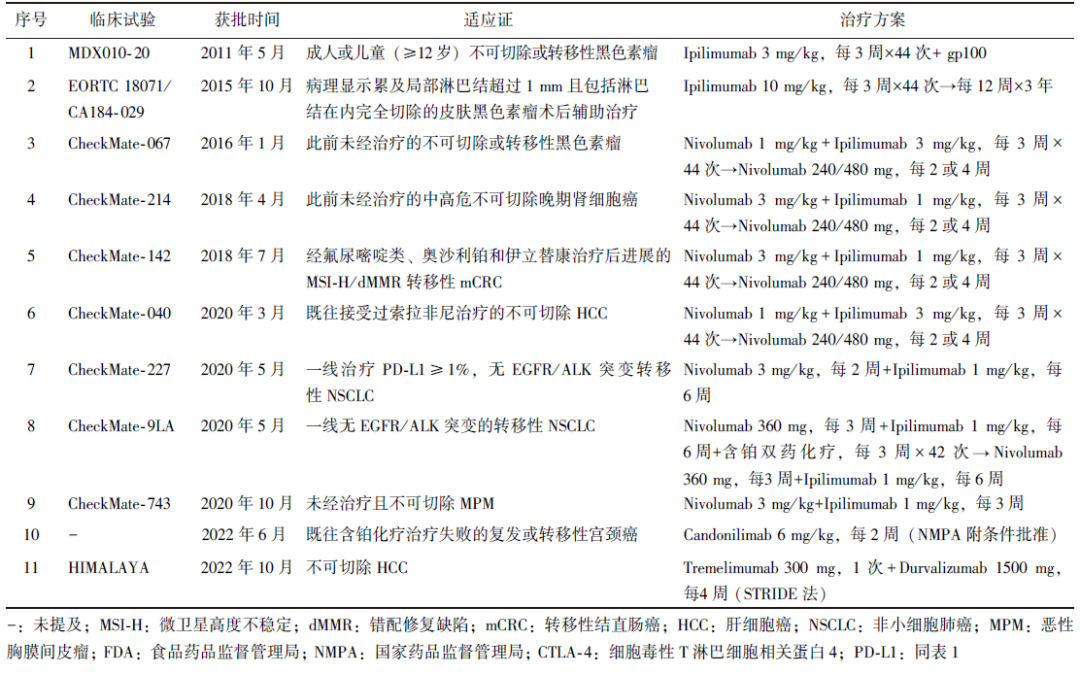
3 抗CTLA-4治疗剂量
3.1 CTLA-4单药治疗剂量
一项临床试验(EORTC 18071)结果表明Ipilimumab单药辅助治疗术后高危黑色素瘤剂量为10 mg/kg[23],而另一项研究(E1609)显示[34],与高剂量干扰素α (79%)相比,Ipilimumab剂量分别为3 mg/kg和10 mg/kg时,3级及以上AE发生率分别为37%、58%,Ipilimumab剂量不仅与AE发生率及药物毒性呈正相关,且疗效并不优于高剂量干扰素α,但3 mg/kg的Ipilimumab治疗剂量有利于远期的生存获益。
两项临床试验(CA184-156、CA184-104)研究显示,在小细胞肺癌(SCLC)和晚期肺鳞癌患者中Ipilimumab联合治疗(10 mg/kg,每4周×4个周期治疗后予以每12周维持治疗)中半数患者未完成治疗,3级及以上AE发生率较高,OS并未改善[35-36]。
3.2 “O+Y”联合治疗剂量
目前,Ipilimumab在不同瘤种中的联合使用剂量无法统一,但多数临床试验均保持长期低剂量(1 mg/kg,每3周或每6周)疗法且联合治疗效果优于单药治疗,联合治疗患者ORR较长且缓解程度更高。联合治疗不同剂量组合方式及药物安全性,见表3,4[27-28,37-42]。
表3 CheckMate系列研究中联合治疗剂量

表4 CTLA-4单药或联合治疗AE发生率[%(n/N)]
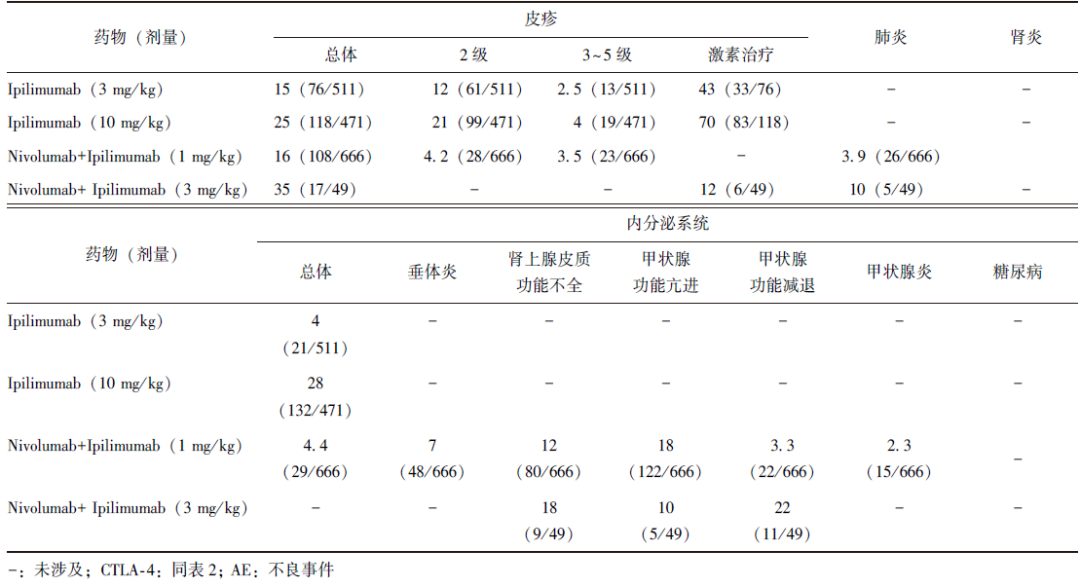
4 小结与展望
CTLA-4使临床医生对于免疫治疗的认识更进一步,对双免疫疗法更加期待。目前,已被美国FDA获批的CTLA-4抑制剂仅有Ipilimumab和Tremelimumab。Ipilimumab仅在黑色素瘤的特定情况下获批单药治疗,其余均为联合治疗。
目前,仍存在药物种类少、适应证范围窄、缺乏最佳剂量和治疗策略等问题。截至目前,在ClinicalTrails.gov 网站登记记注册的CTLA-4临床试验共238项,其中正在开展的有119项。
在中国临床试验注册中心(China Clinical Trail Registry)注册开展的CTLA-4临床试验均为联合治疗但数量不多。此外,现有的联合治疗虽然有不同组合的尝试和探索,但疗效有限。
一项Ⅲ期临床试验(CheckMate 451)研究表明[43], “O+Y”联合治疗SCLC未能改善患者OS和PFS,另一项Ⅱ期STIMULI临床研究显示[44],对于“O+Y”联合治疗用于同步放化疗后局限期SCLC的维持治疗效果有限。“D+T”一线治疗Ⅳ期NSCLC相较于含铂标准化疗未能改善患者OS[45],另一项Ⅱ期MYSTIC临床研究显示Durvalumab单药或“D+T”联合治疗均未能显著提高Ⅳ期NSCLC患者OS[46]。
此外,联合治疗效果并不一定优于单药治疗,一项针对PD-L1 TPS≥50%且无EGFR或ALK基因突变转移性NSCLC患者的Ⅲ期临床试验(KEYNOTE-598)显示,Pembrolizumba+Ipilimumab(“K+Y”)治疗与Pembrolizumba单药治疗相比,OS及PFS均未显著提高,且AE发生率高达76.2%,其中3级及以上AE占比35.1%[47]。未来应针对双免疫疗法在不同瘤种中合适的治疗时机、不同组合形式和应用策略进一步进行探索和研究。
此外,还需深刻意识到免疫治疗的复杂性、不确定性和风险性。应重视抗CTLA-4单药治疗及“O+Y”联合治疗的AE发生情况,早期临床试验多采用高频率、大剂量Ipilimumab单药治疗,一项采用10 mg/kg,每3周×4个周期Ipilimumab单药治疗的临床试验(CA184-104)显示,AE发生率高达53%,停药率28%,高于化疗组,且仅有46%的 Ipilimumab组患者完成治疗,其中还包括调整了化疗或Ipilimumab剂量的患者,最常见AE(发生率≥5%)为疲乏、腹泻、皮肤瘙痒、皮疹和结肠炎[35]。
而“O+Y”联合治疗的AE也有不同程度的叠加,尤其是免疫相关不良反应(irAE)(包括胃肠道、肺部及皮肤发生AE及肝毒性等)(表4),因而在CheckMate系列研究中,逐步对Ipilimumab采用低剂量、长疗程、大间隔治疗策略。
CheckMate743研究显示[38],联合治疗的AE发生率由高至低依次为皮疹(25%)、疲乏(22%)、腹泻(21%)、瘙痒(16%)、甲状腺功能减退(11%)、恶心(10%),绝大多数为轻度至中度(1级或2级)。此外,并非联合治疗的毒副反应一定高于化疗、靶向治疗,如在HIMALAYA研究中[30],“D+T”组合的3级及以上AE发生率仅为25.8%,并未增加严重肝毒性和出血风险,而Sorafenib组为36.9%。
以Ipilimumab为代表的CTLA-4抑制剂上市多年但未能在多种实体肿瘤有较大突破,原因可能是CTLA-4作用机制及与PD-1/PD-L1信号通路相关性尚不明确,不同IgG抗体类型、PH依赖性抗体、抗原表位差异等导致药物疗效难以达到预期目标[48-51],随着PD-1/CTLA-4联合治疗药物的出现或许能够解决上述问题。
综上所述,由于免疫治疗具有复杂性、不确定性及一定风险,故仍需更充分的循证医学证据,通过精确的生物标记物筛选出免疫治疗的优势人群,精准预测免疫治疗疗效和风险。对于不同瘤种、不同治疗阶段的CTLA-4抑制剂联合使用,应在循证医学、国内外相关指南的指导下审慎进行。
参考文献
[1]Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011,144: 646-674.
[2]Hanahan D. Hallmarks of Cancer: New Dimensions[J]. Cancer Discov, 2022, 12: 31-46.
[3]Ephraim R, Fraser S, Nurgali K, et al. Checkpoint Markers and Tumor Microenvironment: What Do We Know?[J]. Cancers (Basel), 2022, 14: 3788.
[4]Maruhashi T, Sugiura D, Okazaki IM, et al. LAG-3: from molecular functions to clinical applications[J]. J Immunother Cancer, 2020, 8: e001014.
[5]Freed-Pastor WA, Lambert LJ, Ely ZA, et al. The CD155/TIGIT axis promotes and maintains immune evasion in neoantigen-expressing pancreatic cancer[J]. Cancer Cell, 2021, 39: 1342-1360.
[6]Azuma M, Ito D, Yagita H, et al. B70 antigen is a second ligand for CTLA-4 and CD28[J]. Nature, 1993, 366: 76-79.
[7]Krummel MF, Allison JP. CTLA-4 engagement inhibits IL-2 accumulation and cell cycle progression upon activation of resting T cells[J]. J Exp Med, 1996, 183: 2533-2540.
[8]Parry RV, Chemnitz JM, Frauwirth KA, et al. CTLA-4 and PD-1 receptors inhibit T-cell activation by distinct mechanisms[J]. Mol Cell Biol, 2005, 25: 9543-9553.
[9]Ribas A. Releasing the Brakes on Cancer Immunotherapy[J]. N Engl J Med, 2015, 373: 1490-1492.
[10]Takahashi T, Tagami T, Yamazaki S, et al. Immunologic self-tolerance maintained by CD25(+)CD4(+) regulatory T cells constitutively expressing cytotoxic T lymphocyte-associated antigen 4[J]. J Exp Med, 2000, 192: 303-310.
[11]Qureshi OS, Zheng Y, Nakamura K, et al. Trans-endocytosis of CD80 and CD86: a molecular basis for the cell-extrinsic function of CTLA-4[J]. Science, 2011, 332: 600-603.
[12]Wei SC, Duffy CR, Allison JP. Fundamental Mechanisms of Immune Checkpoint Blockade Therapy[J]. Cancer Discov, 2018, 8: 1069-1086.
[13]Hou TZ, Qureshi OS, Wang CJ, et al. A transendocytosis model of CTLA-4 function predicts its suppressive behavior on regulatory T cells[J]. J Immunol, 2015, 194: 2148-2159.
[14]Pedicord VA, Montalvo W, Leiner IM, et al. Single dose of anti-CTLA-4 enhances CD8+ T-cell memory formation, function, and maintenance[J]. Proc Natl Acad Sci USA, 2011, 108: 266-271.
[15]Weber JS, Hamid O, Chasalow SD, et al. Ipilimumab increases activated T cells and enhances humoral immunity in patients with advanced melanoma[J]. J Immunother, 2012, 35: 89-97.
[16]Selby MJ, Engelhardt JJ, Quigley M, et al. Anti-CTLA-4 antibodies of IgG2a isotype enhance antitumor activity through reduction of intratumoral regulatory T cells[J]. Cancer Immunol Res, 2013, 1: 32-42.
[17]Sharma A, Subudhi SK, Blando J, et al. Anti-CTLA-4 Immunotherapy Does Not Deplete FOXP3(+) Regulatory T Cells (Tregs) in Human Cancers[J]. Clin Cancer Res, 2019,25:1233-1238.
[18]Felix J, Lambert J, Roelens M, et al. Ipilimumab reshapes T cell memory subsets in melanoma patients with clinical response[J]. Oncoimmunology, 2016, 5: 1136045.
[19]Gubin MM, Esaulova E, Ward JP, et al. High-Dimensional Analysis Delineates Myeloid and Lymphoid Compartment Remodeling during Successful Immune-Checkpoint Cancer Therapy[J]. Cell, 2018, 175: 1014-1030.
[20]Rotte A. Combination of CTLA-4 and PD-1 blockers for treatment of cancer[J]. J Exp Clin Cancer Res, 2019,38:255.
[21]Willsmore ZN, Coumbe B, Crescioli S, et al. Combined anti-PD-1 and anti-CTLA-4 checkpoint blockade: Treatment of melanoma and immune mechanisms of action[J]. Eur J Immunol, 2021,51: 544-556.
[22]McDermott D, Haanen J, Chen TT, et al. Efficacy and safety of ipilimumab in metastatic melanoma patients surviving more than 2 years following treatment in a phase Ⅲ trial (MDX010-20)[J]. Ann Oncol, 2013, 24: 2694-2698.
[23]Eggermont AM, Chiarion-Sileni V, Grob JJ, et al. Adjuvant ipilimumab versus placebo after complete rep of high-risk stage Ⅲ melanoma (EORTC 18071): a randomised, double-blind, phase 3 trial[J]. Lancet Oncol, 2015, 16: 522-530.
[24]Hodi FS, Chiarion-Sileni V, Gonzalez R, et al. Nivolumab plus ipilimumab or nivolumab alone versus ipilimumab alone in advanced melanoma (CheckMate 067): 4-year outcomes of a multicentre, randomised, phase 3 trial[J]. Lancet Oncol, 2018, 19: 1480-1492.
[25]Motzer RJ, Tannir NM, McDermott DF, et al. Nivolumab plus Ipilimumab versus Sunitinib in Advanced Renal-Cell Carcinoma[J]. N Engl J Med, 2018, 378: 1277-1290.
[26]Reck M, Schenker M, Lee KH, et al. Nivolumab plus ipilimumab versus chemotherapy as first-line treatment in advanced non-small-cell lung cancer with high tumour mutational burden: patient-reported outcomes results from the randomised, open-label, phase Ⅲ CheckMate 227 trial[J]. Eur J Cancer, 2019, 116: 137-147.
[27]Paz-Ares LG, Ramalingam SS, Ciuleanu TE, et al. First-Line Nivolumab Plus Ipilimumab in Advanced NSCLC: 4-Year Outcomes From the Randomized, Open-Label, Phase 3 CheckMate 227 Part 1 Trial[J]. J Thorac Oncol, 2022, 17: 289-308.
[28]Paz-Ares L, Ciuleanu TE, Cobo M, et al. First-line nivolumab plus ipilimumab combined with two cycles of chemotherapy in patients with non-small-cell lung cancer (CheckMate 9LA): an international, randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2021, 22: 198-211.
[29]Baas P, Scherpereel A, Nowak AK, et al. First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial[J]. Lancet, 2021, 397: 375-386.
[30]Kudo M. Durvalumab Plus Tremelimumab: A Novel Combination Immunotherapy for Unresectable Hepatocellular Carcinoma[J]. Liver Cancer, 2022, 11: 87-93.
[31]Overman MJ, McDermott R, Leach JL, et al. Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study[J]. Lancet Oncol, 2017, 18: 1182-1191.
[32]Yau T, Kang YK, Kim TY, et al. Efficacy and Safety of Nivolumab Plus Ipilimumab in Patients With Advanced Hepatocellular Carcinoma Previously Treated With Sorafenib: The CheckMate 040 Randomized Clinical Trial[J]. JAMA Oncol, 2020, 6: e204564.
[33]朱军, 黄美金, 陈宏. 进展期胃癌免疫治疗的研究进展[J]. 癌症进展, 2022, 20: 1189-1193.
[34]Tarhini AA, Kang N, Lee SJ, et al. Immune adverse events (irAEs) with adjuvant ipilimumab in melanoma, use of immunosuppressants and association with outcome: ECOG-ACRIN E1609 study analysis[J]. J Immunother Cancer, 2021, 9: e002535.
[35]Govindan R, Szczesna A, Ahn MJ, et al. Phase Ⅲ Trial of Ipilimumab Combined With Paclitaxel and Carboplatin in Advanced Squamous Non-Small-Cell Lung Cancer[J]. J Clin Oncol, 2017, 35: 3449-3457.
[36]Kang S, Wang X, Zhang Y, et al. First-Line Treatments for Extensive-Stage Small-Cell Lung Cancer With Immune Checkpoint Inhibitors Plus Chemotherapy: A Network Meta-Analysis and Cost-Effectiveness Analysis[J]. Front Oncol, 2021, 11: 740091.
[37]Yu J, Ma S, Tian S, et al. Systematic Construction and Validation of a Prognostic Model for Hepatocellular Carcinoma Based on Immune-Related Genes[J]. Front Cell Dev Biol, 2021, 9: 700553.
[38]Cedres S, Felip E. 3-Year CheckMate743 outcomes: ringing in immunotherapy for the treatment of malignant pleural mesothelioma[J]. Ann Oncol, 2022, 33: 457-459.
[39]Takei S, Kawazoe A, Shitara K. The New Era of Immunotherapy in Gastric Cancer[J]. Cancers (Basel), 2022, 14: 1054.
[40]Weiss SA, Kluger H. CheckMate-067: Raising the Bar for the Next Decade in Oncology[J]. J Clin Oncol, 2022, 40: 111-113.
[41]Zhang X, Wu T, Cai X, et al. Neoadjuvant Immunotherapy for MSI-H/dMMR Locally Advanced Colorectal Cancer: New Strategies and Unveiled Opportunities[J]. Front Immunol, 2022, 13: 795972.
[42]Cavillon A, Pouessel D, Houédé N, et al. Assessing Long-term Treatment Benefits Using Complementary Statistical Approaches: An In Silico Analysis of the Phase Ⅲ Keynote-045 and Checkmate-214 Immune Checkpoint Inhibitor Trials[J]. Eur Urol, 2023, 25: S0302-2838(23)02619-2.
[43]Owonikoko TK, Park K, Govindan R, et al. Nivolumab and Ipilimumab as Maintenance Therapy in Extensive-Disease Small-Cell Lung Cancer: CheckMate 451[J]. J Clin Oncol, 2021, 39: 1349-1359.
[44]Peters S, Pujol JL, Dafni U, et al. Consolidation nivolumab and ipilimumab versus observation in limited-disease small-cell lung cancer after chemo-radiotherapy - results from the randomised phase Ⅱ ETOP/IFCT 4-12 STIMULI trial[J]. Ann Oncol, 2022, 33: 67-79.
[45]Mariniello A, Novello S, Scagliotti GV, et al. Double immune checkpoint blockade in advanced NSCLC[J]. Crit Rev Oncol Hematol, 2020, 152: 102980.
[46]Rizvi NA, Cho BC, Reinmuth N, et al. Durvalumab With or Without Tremelimumab vs Standard Chemotherapy in First-line Treatment of Metastatic Non-Small Cell Lung Cancer: The MYSTIC Phase 3 Randomized Clinical Trial[J]. JAMA Oncol, 2020, 6: 661-674.
[47]Boyer M,Şendur M, Rodríguez-Abreu D, et al. Pembrolizumab Plus Ipilimumab or Placebo for Metastatic Non-Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score ≥ 50%: Randomized, Double-Blind Phase Ⅲ KEYNOTE-598 Study[J]. J Clin Oncol, 2021, 39: 2327-2338.
[48]Lee JY, Lee HT, Shin W, et al. Structural basis of checkpoint blockade by monoclonal antibodies in cancer immunotherapy[J]. Nat Commun, 2016, 7: 13354.
[49]He M, Chai Y, Qi J, et al. Remarkably similar CTLA-4 binding properties of therapeutic ipilimumab and tremelimumab antibodies[J]. Oncotarget, 2017, 8: 67129-67139.
[50]Ramagopal UA, Liu W, Garrett-Thomson SC, et al. Structural basis for cancer immunotherapy by the first-in-class checkpoint inhibitor ipilimumab[J]. Proc Natl Acad Sci USA, 2017, 114: E4223-E4232.
[51]左乔竹, 覃文新. CTLA-4和PD-1信号通路在实体瘤治疗中的研究进展[J]. 生命科学, 2017, 29: 713-721.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)